Portrait global 2014
Avant-propos
Pour la troisième fois, le groupe de travail Suivi de l’état du Saint-Laurent a relevé le défi d’établir un portrait global de l’état du Saint-Laurent dans le cadre de l’Entente Canada-Québec sur le Saint-Laurent, aussi appelée « Plan d’action Saint-Laurent 2011-2026 ». Pour ce faire, le groupe a mis à profit les résultats de travaux de nombreux scientifiques appartenant aux organisations engagées dans la mise en oeuvre du programme Suivi de l’état du Saint-Laurent. Nous n’avons pas la prétention d’avoir pris en considération la totalité des études portant sur l’état du Saint-Laurent pour établir ce portrait, mais plutôt celle de publier des résultats découlant directement de ce programme.
En 2014, le groupe de travail a adopté une approche plus visuelle pour présenter ses constats. Des pictogrammes illustrent maintenant chaque indicateur et des schémas conceptuels permettent une meilleure intégration de l’information. En 2014, le grand fleuve affiche un bilan de santé présentant un équilibre fragile. La majorité des indicateurs demeurent dans un état intermédiaire. À la suite de la réintroduction du bar rayé, on enregistre une progression importante sur le plan de la reproduction naturelle, de la croissance et de la répartition de cette espèce dans le fleuve. Toutefois, le Saint-Laurent demeure vulnérable dans son ensemble. Les populations de bélugas et de fous de Bassan connaissent une dégradation importante. Plusieurs changements sont donc observés dans l’écosystème de l’estuaire moyen, de l’estuaire maritime et du golfe.
Nous espérons que les résultats de nos travaux contribueront à éclairer la prise de décisions sur le Saint-Laurent. Grâce aux connaissances qu’il procure, le programme constitue l’un des éléments fondamentaux permettant une gestion intégrée du fleuve. La concertation et l’engagement de nos partenaires gouvernementaux et des organismes non gouvernementaux demeurent des facteurs clés pour assurer la continuité de nos efforts de suivi de l’état du Saint-Laurent, notamment à travers l’établissement de rapports.
Nous sommes très heureuses de présenter le portrait global 2014 et nous tenons à remercier sincèrement tous les membres de notre groupe ainsi que les autres collaborateurs qui ont contribué de près ou de loin à sa réalisation.
Hélène Bouchard
Coprésidente pour le Canada
Groupe de travail
Suivi de l’état du Saint-Laurent
Environnement Canada
Patricia Robitaille
Coprésidente pour le Québec
Groupe de travail
Suivi de l’état du Saint-Laurent
Ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatique
Introduction
Le fleuve Saint-Laurent prend sa source dans les Grands Lacs, au coeur d’une des plus imposantes agglomérations industrielles en Amérique du Nord. Les impacts qu’il a subis au cours du 20e siècle sont nombreux : modification du régime d’écoulement, dégradation de la qualité de l’eau, artificialisation et érosion des rives, déclin de certaines communautés végétales et animales, etc. Malgré les efforts consentis depuis une trentaine d’années pour réduire ces impacts, ce grand cours d’eau demeure vulnérable aussi bien à l’agriculture intensive et aux empiètements dans la plaine inondable qu’au dragage du chenal de navigation et à la régularisation du débit. À cela s’ajoutent de nouveaux enjeux environnementaux tels que les changements climatiques, les espèces envahissantes et les substances toxiques émergentes dont les effets sont peu connus. Dans l’ensemble, quel est l'état de santé du fleuve ? Pour répondre à cette question, un programme de suivi à long terme de l’état du Saint-Laurent a été lancé en 2003, dans le cadre d’une entente Canada-Québec. Différents partenaires vérifient, à intervalles réguliers, une série d’indicateurs environnementaux. Le territoire couvert s’étend de la frontière Ontario-Québec jusqu’au golfe. Après un premier diagnostic publié en 2003 et une mise à jour en 2008, le présent document dresse un troisième portrait global de l’état du Saint-Laurent à partir des plus récents résultats. La première partie du document décrit le programme, la deuxième traite de l’état du Saint-Laurent et de son évolution de façon globale; les constats y sont présentés par tronçon et sous deux angles différents : le fonctionnement de l’écosystème et la contamination par les toxiques. Enfin, dans la troisième partie, des perspectives sont énoncées pour l’avenir de cet écosystème exceptionnel et son suivi.
Le système hydrographique du Saint-Laurent, y compris les Grands Lacs, figure parmi les plus importants au monde. Sa superficie de 1,6 million de kilomètres carrés le classe au troisième rang en importance en Amérique du Nord, après le Mississippi et le fleuve Mackenzie. Il draine plus de 25 % des réserves mondiales d’eau douce et influence les processus environnementaux du continent. Plus de 30 millions d’États-Uniens et 15 millions de Canadiens vivent dans cet immense bassin. (Source : Portrait global 2008)
Description longue
La carte présente le système hydrographique des Grands Lacs (lac Supérieur, lac Michigan, lac Huron, lac Érié, lac Ontario) ainsi que les divers tronçons du fleuve Saint-Laurent. Le tronçon fluvial s’étale de Cornwall à Pointe-du-Lac et est caractérisé par une série de trois lacs fluviaux d’eau douce. L’estuaire fluvial s’étale de Pointe-du-Lac jusqu’à la pointe de l’île d’Orléans et est caractérisé par de l’eau douce. Le début du moyen estuaire marque la transition de l’eau douce vers l’eau saumâtre puis l’eau salée en aval de Baie-Saint-Paul jusqu’à l’embouchure du Saguenay. Le fleuve s’élargit enfin vers l’estuaire maritime et le golfe.

Contexte
Le programme Suivi de l’état du Saint-Laurent, mis sur pied dans le cadre de l’Entente Canada-Québec sur le Saint-Laurent, réunit cinq partenaires gouvernementaux, soit Environnement Canada (EC), le ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques du Québec (MDDELCC), le ministère des Forêts, de la Faune et des Parcs du Québec (MFFP), Pêches et Océans Canada (MPO) et Parcs Canada, ainsi que Stratégies Saint-Laurent (SSL), un organisme non gouvernemental actif auprès des collectivités riveraines. Ces partenaires mettent leur expertise en commun pour rendre compte, à intervalles réguliers, de l’état du Saint-Laurent et de son évolution. Les premiers résultats ont été rendus publics en février 2003, lors de l'événement « Rendez-vous Saint-Laurent ». Puis une mise à jour a été faite en 2008 lors du 20e anniversaire du Plan Saint-Laurent. Cette analyse, axée principalement sur l’eau, les sédiments et les ressources biologiques, concluait que le grand fleuve affichait un bilan de santé qu’on pourrait qualifier d’intermédiaire à bon pour plusieurs indicateurs, malgré le fait qu’il demeurait dans son ensemble relativement vulnérable.
Participation des collectivités
En plus d’apporter leur expertise et leurs connaissances sur l’état du fleuve, les organismes non gouvernementaux contribuent à l’acquisition de données ainsi qu’à la diffusion de l’information générée par le programme. En 2013, six organismes, dont cinq comités ZIP (zone d’intervention prioritaire), ont collaboré au suivi de l’état du Saint-Laurent pour les plantes envahissantes. Pour contribuer efficacement au programme, les collectivités bénéficient d’une formation spécifique et d’un soutien scientifique et technique adapté aux réalités locales.
Objectifs
Le programme est né du besoin, exprimé par de nombreux intervenants, de disposer d’une information la plus à jour possible sur l’état global du Saint-Laurent. Ainsi, l’objectif principal est de fournir, à partir de bases scientifiques solides, une information intégrée afin de favoriser la protection et la pérennité de l’écosystème pour les générations actuelles et futures. Dans un premier temps, les données aident à porter un jugement sur la condition de l’écosystème. Dans un deuxième temps, elles orientent la prise de décisions afin d’assurer sa protection. Le défi consiste à intégrer les données obtenues à partir des indicateurs environnementaux de façon à permettre une meilleure compréhension de l’état du Saint-Laurent et de son évolution. Pour relever ce défi, nous avons donc adopté une démarche progressive afin de transformer et d’enrichir le programme à la lumière des connaissances acquises et des nouveaux partenariats. Le portrait global 2014 adopte donc une nouvelle signature par rapport aux deux derniers, à savoir une approche plus visuelle et conceptuelle afin de relier plus facilement les différents indicateurs de l’écosystème Saint-Laurent.
Cadre de référence
Le Saint-Laurent est un écosystème complexe constitué de lacs et de tronçons fluviaux, d’un long estuaire et d’un golfe aux caractéristiques marines. Ses propriétés physiques (courant, profondeur, masses d’eau, salinité, marée) changent d’amont en aval, lui conférant un caractère dynamique. On y trouve une grande variété d’habitats d’eau douce, estuariens et marins, ainsi qu’une flore et une faune très diversifiées. Comme les caractéristiques physiques naturelles du Saint-Laurent influencent largement la biodiversité et les habitats, il est important d’en tenir compte pour évaluer l’état de santé du fleuve et de bien distinguer les effets naturels des effets induits par les perturbations anthropiques. Dans le cadre du présent portrait, les indicateurs sont présentés en regroupant toutes les activités en eau douce (tronçon et estuaire fluvial), d’une part, et les activités en eau salée (estuaire moyen, estuaire maritime et golfe), d’autre part. La complexité du fleuve est abordée à l’aide d’un cadre de référence simple, constitué de cinq composantes à la base de l’écosystème : l’eau, les sédiments, les ressources biologiques, les rives et les usages. Les indicateurs retenus dans le programme sont classés dans l’une ou l’autre de ces composantes.
Description longue
Dans l’écosystème d’eau douce, on peut observer une coupe transversale du fleuve présentant les différents éléments clés de l’écosystème aquatique, à savoir la communauté de poissons, la communauté d’invertébrés benthiques, les plantes des milieux humides et le Grand Héron. Sur l’eau et sur les rives, les éléments de pression humaine tels que la pêche, l’agriculture, les industries, les rejets d’eaux usées. Dans l’écosystème marin, on peut observer le phytoplancton, le zooplancton, le béluga, les oiseaux marins, les bancs coquilliers. Et sur l’eau et les rives, la pêche commerciale, la floraison d’algues rouges, l’agriculture et les rejets d’eaux usées pouvant être des apports de coliformes fécaux (E. coli).

Indicateur environnemental
- Paramètre mesuré ou statistique calculée
- Élément clé de l’écosystème
- Portée supérieure à la valeur même du paramètre
- Communication efficace des résultats sur l’état de l’écosystème à l’étude ou l’état d’une zone géographique
Trois grandes fonctions :
- Scientifique : évaluer l’état de l’environnement et, lorsqu’elle est observée périodiquement, mettre en évidence une tendance;
- Politique : supporter la prise de décisions;
- Sociétale : faciliter la communication entre les différents intervenants et inciter l’action dans le bon sens.
Aux fins du présent portrait global, la couleur verte réfère de façon générale à un état bon non préoccupant, la couleur jaune, à un état intermédiaire à surveiller, et la couleur rouge, à un état mauvais qui est préoccupant.
Activités de suivi
Le programme Suivi de l’état du Saint-Laurent se caractérise par une démarche évolutive d’amélioration continue. Ainsi, depuis le début du programme, la couverture spatiale et temporelle des activités existantes a été améliorée, de nouvelles activités et de nouveaux indicateurs ont été mis en place et de nouveaux collaborateurs ont été recrutés. Les variables environnementales du fleuve Saint-Laurent ont été retenues pour leur représentativité et leur pertinence en vue d’établir un diagnostic sur l’état du Saint-Laurent et parce que leur couverture spatiale et temporelle est suffisante (voir le tableau 1).
Tableau 1. Indicateurs du suivi de l’état du Saint-Laurent.
| Composante | Pictogramme | Indicateurs | Partenaires | Tronçons suivis |
|---|---|---|---|---|
| Eau |
| Débit et niveau d’eau | Plusieurs partenaires* | Tronçon fluvial |
 | Contamination de l’eau par les toxiques | EC | Tronçon et estuaire fluvial | |
 | Paramètres physicochimiques et bactériologiques | MDDELCC | Tronçon et estuaire fluvial | |
| Processus océanographiques | MPO | Estuaire maritime et golfe | |
| Salubrité des eaux coquillières** | EC | Estuaire moyen, estuaire maritime et golfe | |
| Sédiments |
| Contamination des sédiments par les toxiques | EC | Tronçon et estuaire fluvial |
| Ressources biologiques |  | Communautés benthiques | EC | Tronçon fluvial |
 | Communauté phytoplanctonique | MPO | Estuaire maritime et golfe | |
 | Communauté zooplanctonique | MPO | Estuaire maritime et golfe | |
 | Algues toxiques** | MPO | Estuaire maritime et golfe | |
 | Bar rayé | MFFP | Estuaire fluvial, moyen estuaire et estuaire maritime et golfe | |
 | Contamination des poissons par les toxiques** | MDDELCC | Tronçon fluvial | |
 | Communautés de poissons | MFFP | Tronçon fluvial | |
 | Béluga | MPO | Estuaire moyen et maritime | |
 | Fou de Bassan | EC | Estuaire maritime et golfe | |
 | Contamination du Grand Héron par les toxiques | EC | Estuaire fluvial, moyen estuaire et estuaire maritime et golfe | |
 | Oiseaux marins | EC | Estuaire maritime et golfe | |
 | Milieux humides | EC | Tronçon fluvial | |
 | Espèces envahissantes | MDDELCC, MFFP et MPO | Tronçon et estuaire fluvial |
* MDDELCC, Hydro-Québec, MPO, EC, U.S. Geological Survey, New York Power Authority/Ontario Power, Voie maritime du Saint-Laurent
** Lié à des critères d’usage.
Icône de contamination par les toxiques Contamination par les toxiques.
Améliorations apportées au programme depuis 2008
- Ajout de stations de suivi de la qualité de l’eau dans le fleuve à Lavaltrie et Bécancour et à l’embouchure des rivières Richelieu, Yamaska, Saint-François, Nicolet et Saint-Maurice.
- Extension des travaux de caractérisation des sédiments au tronçon fluvial de Montréal à Sorel et dans la région de Québec.
- Ajout du suivi des espèces animales envahissantes tant en eaux douces qu’en eaux salées (voir les encadrés ci-dessous).
- Suivi des communautés benthiques élargi du lac Saint-François au lac Saint-Pierre.
- Création des pictogrammes qui identifient chaque indicateur, uniformisation dans la diffusion des informations et visualisation des résultats sous forme de schémas conceptuels.
Un programme de monitorage des espèces aquatiques envahissantes a été mis en place par Pêches et Océans Canada afin de dresser un portrait de la situation aux Îles-de-la-Madeleine, en Gaspésie et sur la Côte-Nord. Depuis 2003, diverses espèces aquatiques envahissantes ont été détectées et sont suivies afin de voir leur progression.

Algue Codium © MPO, S. Pereira

Crabe vert © MPO, S. Pereira
Caprelle japonaise © MPO, T. Gosselin

Botrylle étoilé © M. Desraspes

Bryzoaire Membranipora © MPO, I. Bérubé

Ascidie jaune © MPO, B. Vercaemer

Tunicier Diplosoma © R. Groeneveld
Un Réseau de détection précoce des espèces aquatiques exotiques envahissantes du Saint-Laurent a été mis sur pied en 2007 par la Direction régionale du Bas-Saint-Laurent (MFFP). Ce réseau, formé de pêcheurs commerciaux, permet d’avoir une vision actuelle des espèces aquatiques présentes dans le fleuve et de suivre leur évolution de Montréal à Rimouski.
![]()
Crabe chinois à mitaines © MFFP

Gobie à taches noires © UQTR, Andrea Bertolo
![]()
Alose à gésier © MFFP
![]()
Tanche © MFFP, Yves Paradis
![]()
Stromatée à fossettes © MFFP
L’état du saint-laurent et son évolution
Constat global de l’état du Saint-Laurent : Un équilibre fragile
Le portrait global en est maintenant à sa troisième édition. La répartition de tous les indicateurs en fonction du constat de leur état actuel est présentée à la figure 3. La partie supérieure présente les indicateurs en eau salée (en aval de Québec) et la partie inférieure présente les indicateurs en eau douce (Cornwall-Québec). À noter que le suivi de la contamination du Grand Héron se retrouve à la fois en eau douce et en eau salée. Dans l’ensemble, la majorité des indicateurs demeurent dans un état intermédiaire. En fonction de leurs indicateurs respectifs, les sections de l’estuaire moyen, de l’estuaire maritime et du golfe semblent montrer des signes de dégradation plus importants que le tronçon et l’estuaire fluvial. Toutefois, l’échelle d’observation des indicateurs est très importante et les constats peuvent différer d’un secteur du Saint-Laurent à l’autre. Cela explique que plusieurs indicateurs présentent un état intermédiaire; certains secteurs suivis présentent un état bon et d’autres, un état mauvais, ce qui donne un état globalement intermédiaire.
Description longue
La figure représente la répartition de l’état de chaque indicateur sur l’échelle de mauvais à bon, chaque indicateur est identifié par son pictogramme et le cercle de couleur l’entourant est de la même couleur que l’état qu’il représente. Les classes d’état sont les suivantes : mauvais (rouge), intermédiaire-mauvais (orange), intermédiaire (jaune), intermédiaire-bon (jaune-vert) et bon (vert). La partie supérieure représente les indicateurs du milieu marin, soit l’estuaire moyen, l’estuaire maritime et golfe et la partie inférieure le tronçon et l’estuaire fluvial.
À l’échelle globale du Saint-Laurent, certains indicateurs semblent en effet plus sensibles aux changements que d’autres. La réintroduction du bar rayé a connu une progression remarquable, passant d’un état mauvais en 2003 à un état intermédiaire-bon en 2014. Cependant, plusieurs indicateurs se sont dégradés récemment, principalement dans l’estuaire moyen, dans l’estuaire maritime et dans le golfe. La population de bélugas a décliné d’un état intermédiaire en 2008 à un état mauvais en 2014 et la population de fous de Bassan a également décliné d’un état bon en 2003 et 2008 à un état intermédiaire-mauvais en 2014.

Description longue
Chaque portrait global (2003, 2008 et 2014) est représenté sous forme de pointe de tarte en fonction de la répartition de l’état de chaque indicateur. Les classes d’état sont les suivantes : mauvais (rouge), intermédiaire-mauvais (orange), intermédiaire (jaune), intermédiaire-bon (jaune-vert) et bon (vert). En 2003, la répartition était la suivante : 8,3 % bon, 33,3 % intermédiaire-bon, 33,3 % intermédiaire, 16,7 % intermédiaire-mauvais et 8,3 % mauvais. En 2008, la répartition était la suivante : 8,3 % bon, 25 % intermédiaire-bon, 58,3 % intermédiaire, 8,3 % intermédiaire-mauvais et 0 % mauvais). En 2014, la répartition va comme suit : 0 % bon, 41,7 % intermédiaire-bon, 41,7 % intermédiaire, 8,3 % intermédiaire-mauvais et 8,3 % mauvais.

Corridor fluvial
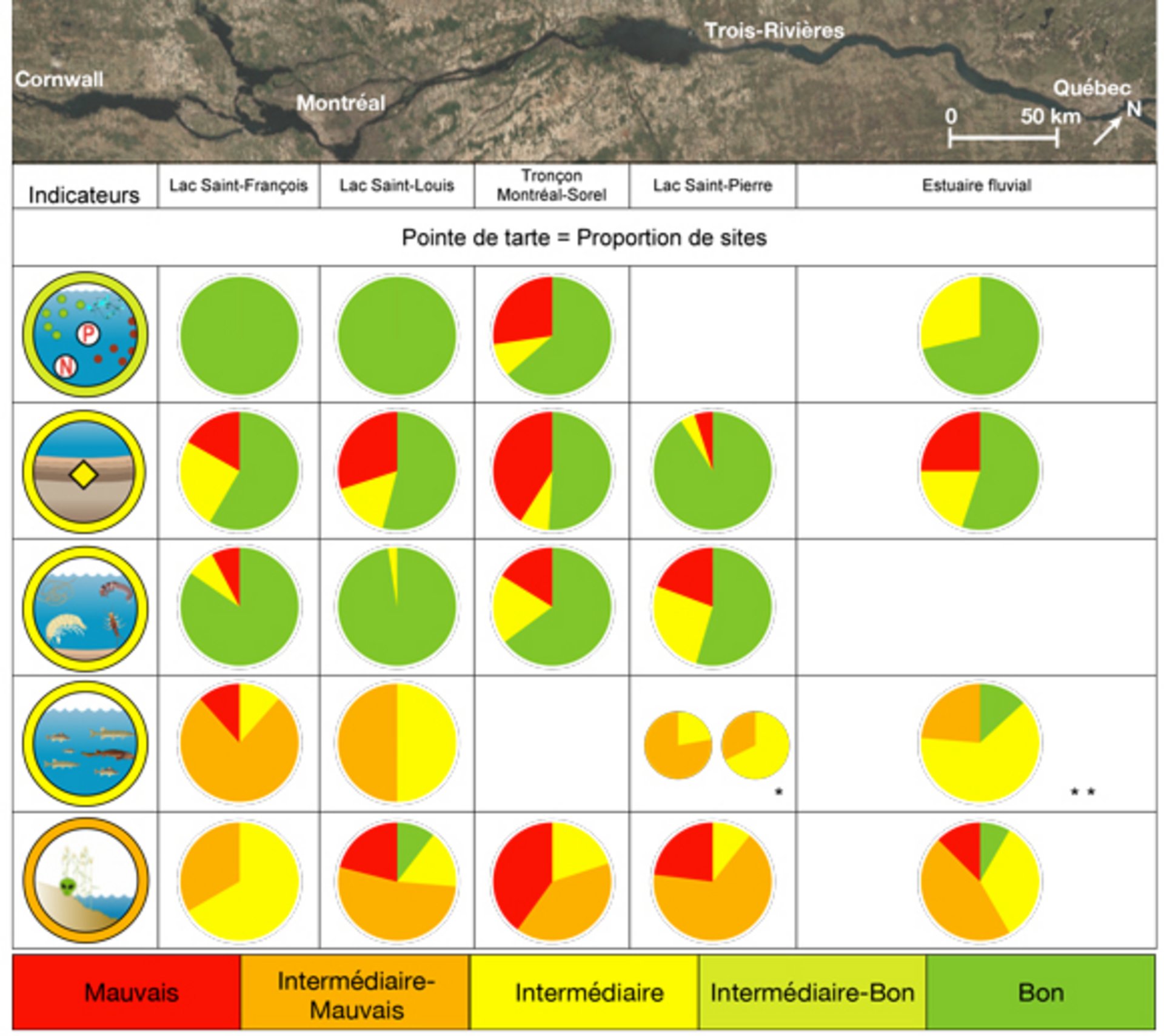
Le corridor fluvial s’étend de Cornwall à Québec et est constitué de divers lacs fluviaux, soit le lac Saint-François, le lac Saint-Louis et le lac Saint-Pierre, et de portions fluviales comme le tronçon entre Montréal et Sorel qui comporte de nombreuses îles. La figure 5 permet de visualiser à une échelle plus fine les constats observés dans les différents tronçons de la partie fluviale du Saint-Laurent. Les pointes de tarte représentent, pour chaque indicateur, la proportion de sites dont l’état a été évalué comme bon, intermédiaire et mauvais (vert, jaune et rouge) ou en cinq classes, avec l’ajout de la catégorie intermédiaire-mauvais, en orange, et intermédiaire-bon, en vert pâle. Chaque indicateur est décrit plus en détail dans les pages suivantes. Dans le coin supérieur gauche est habituellement présenté le pictogramme qui illustre l’indicateur. L’anneau de couleur autour du pictogramme précise le constat de l’état global de cet indicateur selon les cinq classes présentées plus haut (rouge = mauvais; orange = intermédiaire-mauvais; jaune = intermédiaire; vert pâle = intermédiaire-bon; vert foncé = bon). Le fond de carte est une image satellitaire et on y présente les sites échantillonnés. Plusieurs indicateurs présentent divers niveaux d’information, un constat à l’échelle du site échantillonné, un constat pour le tronçon du fleuve, qui correspond au constat sectoriel, et le constat global de l’indicateur pour l’ensemble des sites échantillonnés.
Paramètres physiques, chimiques et bactériologiques de l’eau et leurs effets sur l’écosystème
* Le constat de gauche correspond à l’archipel du lac Saint-Pierre et celui de droite, aux rives nord et sud du lac Saint-Pierre.
** Ce constat concerne seulement le tronçon situé entre les villes de Bécancour et de Batiscan.
Description longue
Le tableau ci-dessus décrit les proportions des sites qui présentent un état en trois classes (bon (vert), intermédiaire (jaune), mauvais (rouge)) ou cinq classes (bon (vert), intermédiaire-bon (jaune-vert), intermédiaire (jaune), intermédiaire-mauvais (orange) ou mauvais (rouge)).
Description longue
On peut observer une coupe transversale du fleuve présentant les différents indicateurs clés de l’écosystème aquatique d’eau douce selon les catégories « eau » et « ressources biologiques », chaque indicateur étant représenté par son pictogramme respectif. La composante « eau » est représentée par les débits et niveaux d’eau et la physicochimie et bactériologie de l’eau; les ressources biologiques sont représentées par la communauté de poissons, la communauté d’invertébrés benthiques, les plantes envahissantes des milieux humides et les milieux humides.
Un écosystème aquatique en santé comporte une quantité et une qualité d’eau permettant aux communautés biologiques d’y vivre, de s’y nourrir et de s’y reproduire afin de créer une diversité biologique d’espèces tant en ce qui concerne les communautés benthiques et les poissons qu’en ce qui concerne les plantes de milieux humides. Un écosystème aquatique en santé se maintient sur le plan de la structure, des processus et des fonctions écologiques de l’écosystème et permet une résilience aux changements, tout en conservant une variabilité naturelle. Au sein d’un écosystème aquatique, de nombreux liens complexes existent dans les réseaux trophiques, les différentes composantes agissant les unes sur les autres. Il est par conséquent difficile de cerner dans une étude de suivi les causes des changements observés dans l’écosystème. Les travaux de recherche peuvent, à cet effet, venir apporter plus d’éléments explicatifs de cause à effet.

Débits et niveaux d’eau
Description longue
Le graphique présente les courbes des débits journaliers calculés à Sorel en mètres cubes par seconde pour les années 2008, 2009, 2010, 2011 et 2012. L’axe des y est représenté par les jours juliens (du 1er janvier au 31 décembre). En 2008, les débits ont varié de 7 700 à 15 800 m3/s, en 2009 de 8 300 à 15 200 m3/s, en 2010 de 7 200 à 12 400 m3/s, en 2011 de 8 100 à 14 700 m3/s et en 2012 de 7 000 à 14 300 m3/s. Les années 2008, 2009 et 2011 se ressemblent beaucoup avec des débits moyens annuels près de la moyenne historique, alors que les débits observés lors des années 2010 et 2012 sont plus faibles.
Le fleuve Saint-Laurent est alimenté par deux principaux bassins contrôlés : les Grands Lacs et la rivière des Outaouais. Le débit à l’exutoire du lac Ontario près de Cornwall varie généralement entre 6 000 et 9 000 m3/s au cours d’une année (débit moyen annuel : 7 060 m3/s), alors que celui de la rivière des Outaouais à Carillon varie entre 1 000 et 8 000 m3/s (débit moyen annuel : 1 910 m3/s). Plusieurs tributaires contribuent aussi au débit du fleuve le long de son parcours vers l’estuaire, les plus importants étant les rivières Richelieu et Saint-Maurice.
Le débit du fleuve Saint-Laurent varie beaucoup d’une année à l’autre et dépend des variations interannuelles des apports en eau au lac Ontario, elles-mêmes dépendantes des conditions climatiques. Au cours des dernières décennies, le patron d’écoulement du Saint-Laurent a été modifié par de nombreuses interventions humaines, dont les répercussions, locales ou étendues, ont une incidence directe sur le niveau de l’eau. Ainsi, l’utilisation du niveau comme indicateur de la quantité d’eau dans le Saint-Laurent demeure utile mais a une portée limitée. Le débit du fleuve est donc un meilleur indicateur de son hydraulicité.
Pour la période de 2008 à 2012, la variation interannuelle et saisonnière a été importante (figure 7). Les années 2008, 2009 et 2011 se ressemblent beaucoup avec des débits moyens annuels près de la moyenne historique, alors que les débits observés lors des années 2010 et 2012 sont plus faibles. Entre autres, la crue observée en 2010 a été très faible, avec un pic de crue pratiquement inexistant et des débits subséquents très faibles jusqu’au milieu de l’été. Pour 2012, la crue a été hâtive et les débits ont diminué rapidement par la suite pour afficher des valeurs sous la barre de 7 500 m3/s durant une période prolongée à partir du milieu de l’été.

Qualité de l’eau
Description longue
La carte présente la situation géographique des sites d’échantillonnage de la qualité physicochimique et bactériologique de l’eau dans le tronçon fluvial s’étendant du lac Saint-François jusqu’à Québec, de 2008 à 2010. La couleur vert correspond à une qualité de l’eau bonne ou satisfaisante, qui est non préoccupante, la couleur jaune correspond à une qualité de l’eau douteuse, qui est à surveiller, et la couleur rouge représente une qualité de l’eau mauvaise ou très mauvaise, qui est préoccupante. Les sites sont ensuite regroupés en pointes de tarte par tronçon du fleuve. Lac Saint-François et lac Saint-Louis : vert (100 %); tronçon Montréal-Sorel : vert (64 %), jaune (9 %) et rouge (27 %); estuaire fluvial : vert (71 %) et jaune (29 %). Le constat global associé à l’indicateur est intermédiaire-bon.
Le constat de la qualité de l’eau par les paramètres physicochimiques et bactériologiques est intermédiaire-bon, soit une légère dégradation depuis le dernier rapport. On observe en effet une diminution de la qualité bactériologique qui résulterait d’une augmentation du débit et des débordements d’eaux usées non traitées à la suite de précipitations plus importantes au cours des dernières années. En effet, les précipitations annuelles moyennes enregistrées de mai à octobre dans le Québec méridional ont augmenté entre 2000 et 2010. Le pourcentage annuel de stations de qualité bonne ou satisfaisante a toujours été supérieur à 59 % au cours de la période de 1995 à 2010, mais il est passé de 75 % entre 2003 et 2005 à 67 % entre 2008 et 2010.
La qualité de l’eau à la hauteur de Québec dépend des sources de pollution qui sont situées en amont, mais elle est également influencée par les précipitations et le débit. Elle permet de synthétiser sommairement ce qui se passe à l’échelle du Saint-Laurent fluvial. Pour la période de 1995 à 2010, on n’observe aucune tendance significative dans les concentrations de matières en suspension et de phosphore. On observe par contre une légère augmentation des concentrations de coliformes fécaux, les valeurs estimées passant de 107 UFC/100 ml au début de la période à 171 UFC/100 ml à la fin de 2010.

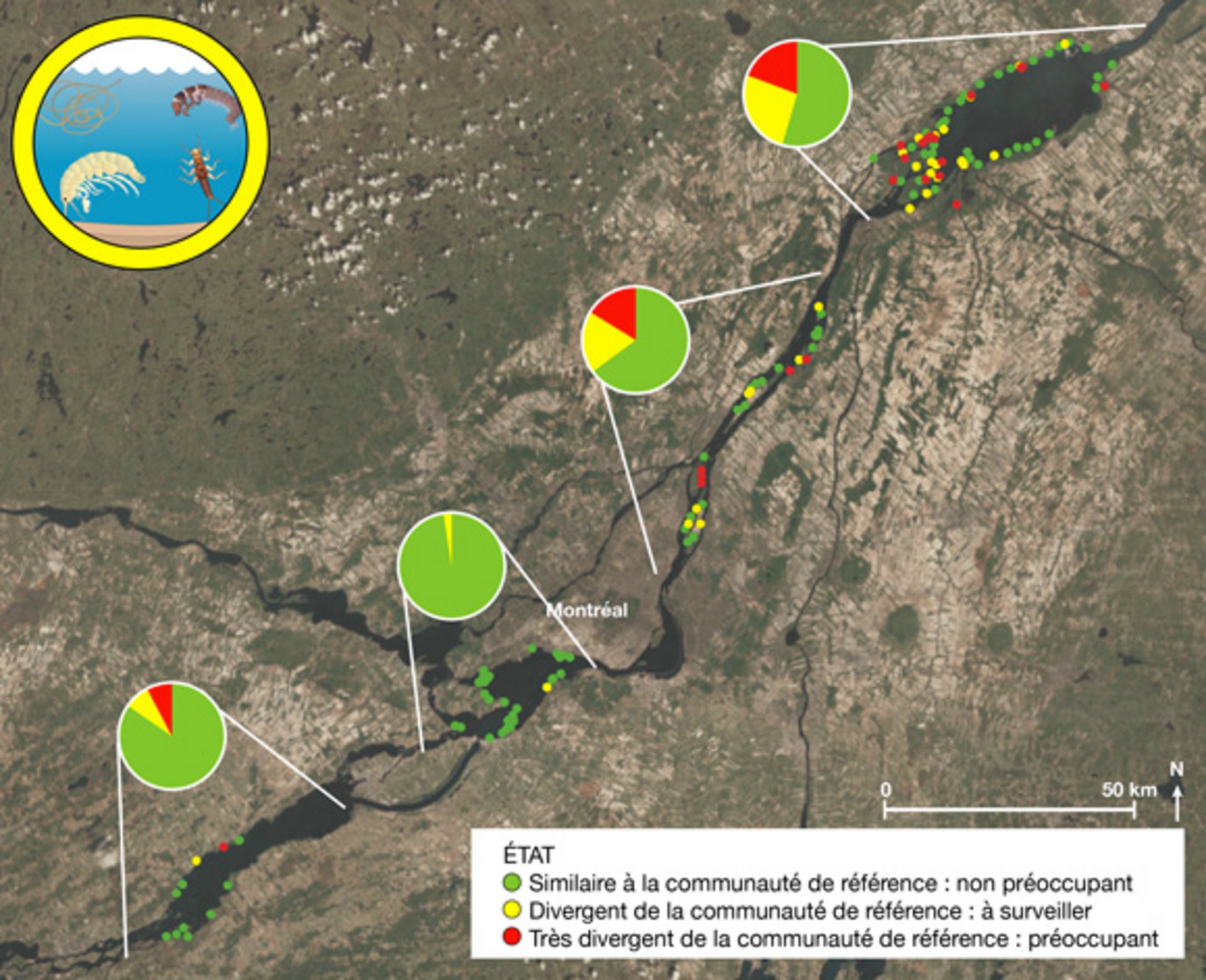
Communauté de macroinvertébrés
Description longue
La carte présente la situation géographique des sites d’échantillonnage des macroinvertébrés benthiques dans le tronçon fluvial s’étendant du lac Saint-François au lac Saint-Pierre, de 2004 à 2010. La couleur vert correspond à un état similaire ou de meilleure qualité qu’aux sites de référence, la couleur jaune correspond à un état qui diverge un peu de la référence (entre le 25e et le 10e centile ou entre le 75e et le 90e centile) et la couleur rouge représente les sites les plus perturbés, où la qualité diverge beaucoup de la référence (< 10e centile ou > 90e centile). Les sites sont ensuite regroupés en pointes de tarte par tronçon du fleuve. Lac Saint-François : vert (84 %), jaune (8 %) et rouge (8 %); lac Saint-Louis : vert (98 %) et jaune (2 %); tronçon Montréal-Sorel : vert (65 %), jaune (19 %) et rouge (16 %); lac Saint-Pierre : vert (55 %), jaune (26 %) et rouge (19 %). Le constat global associé à l’indicateur est intermédiaire.
Le constat général de l’indicateur sur les communautés de macroinvertébrés benthiques du tronçon fluvial est intermédiaire, soit le même constat que celui fait sur les données du lac Saint-Pierre en 2004. Trois paramètres sont considérés pour statuer sur la communauté, soit le nombre de taxons, le pourcentage d’éphéméroptères, de plécoptères et de trichoptères (groupe d’insectes sensibles à la pollution) ainsi que le pourcentage d’oligochètes (groupe de vers tolérants à la pollution). Pour statuer de l’état du site, les critères ont été établis à partir des données de sites de référence considérés comme les sites les moins perturbés. La couleur vert correspond donc à un état similaire ou de meilleure qualité que les sites de référence, la couleur jaune correspond à un état qui diverge un peu de la référence (entre le 25e et 10e centile ou entre le 75e et 90e centile) et la couleur rouge représente les sites les plus perturbés, qui diverge le plus de la référence (< 10e centile ou > 90e centile). Bien que les paramètres retenus évaluent différentes propriétés des communautés benthiques, ils réagissent de façon similaire. Une fois combinés, on observe que les communautés benthiques les plus dégradées se retrouvent dans le tronçon fluvial et dans l’archipel Berthier-Sorel et, dans une moindre mesure, sur la rive nord du lac Saint-François.
Communauté de poissons
Description longue
La carte présente les pointes de tarte illustrant la répartition de l’indice de santé des communautés de poissons. La couleur vert correspond à un indice bon, la couleur jaune représente un indice moyen, la couleur orange correspond à un indice faible et la couleur rouge représente un indice très faible. Lac Saint-François : jaune (11 %), orange (77 %) et rouge (12 %); lac Saint-Louis : jaune (50 %) et orange (50 %); archipel Berthier-Sorel : jaune (22 %) et orange (78 %); lac Saint-Pierre : jaune (68 %) et orange (32 %); Bécancour-Batiscan : vert (13 %), jaune (63 %) et orange (24 %). Le constat global associé à l’indicateur est intermédiaire.
Écosystème unique en Amérique du Nord, le Saint-Laurent fluvial se transforme graduellement en estuaire, puis en une mer intérieure avant de rejoindre l’Atlantique. Les 118 espèces de poissons d’eau douce qu’on y retrouve reflètent toute sa diversité et toute sa complexité. Parmi celles-ci, une quinzaine d’espèces migratrices utilise alternativement les habitats d’eau salée et d’eau douce pour compléter leur cycle vital. Plus de la moitié de ces espèces sont dans une situation précaire en raison des problèmes découlant des activités humaines qu’elles rencontrent en eau douce.
Depuis 1995, le réseau de suivi ichtyologique (RSI) mené par le MFFP prélève de façon standardisée et reproductible une grande quantité de données sur les poissons et leurs habitats dans la section fluviale du Saint-Laurent. Ces données sont utilisées pour évaluer l’état de santé des communautés de poissons, entre autres grâce à un indice d’intégrité biotique (IIB). L’IIB comprend 12 descripteurs, dont la diversité des espèces, leur abondance relative pour certains niveaux trophiques (p. ex., insectivore, omnivore, piscivore, etc.), la contribution des espèces tolérantes et intolérantes à la pollution et la prévalence d’anomalies externes sur les poissons (La Violette et coll., 2003).
Les résultats de l’IIB suggèrent que l’état de santé des communautés de poissons du Saint-Laurent fluvial demeure globalement stable depuis 1995, à l’intérieur de valeurs faible à moyenne (figure 10). L’analyse détaillée de l’indice indique une très grande variabilité entre les divers secteurs du fleuve, témoignant localement de certaines améliorations ou détériorations de l’état de santé des communautés de poissons.
Il est important de noter que l’IIB intègre un amalgame d’information et dresse donc un portrait global de l’état des communautés de poissons du fleuve Saint-Laurent. Afin de raffiner cette évaluation, une analyse détaillée par espèce demeure essentielle pour mettre en lumière certaines tendances très contrastées entre les espèces et les secteurs (tableau 2). À titre d’exemple, une augmentation de l’abondance de l’esturgeon jaune a été observée dans le fleuve Saint-Laurent au cours de la dernière décennie. De plus, la découverte de nouvelles frayères et le retour de l’espèce sur certaines frayères abandonnées confirment que la situation de l’esturgeon jaune s’améliore dans le Saint-Laurent. La réintroduction du bar rayé après sa disparition dans l’estuaire à la fin des années 1960 est également bien amorcée et l’espèce s’y reproduit naturellement (voir l’indicateur sur le bar rayé). À l’opposé, l’anguille d’Amérique a connu un déclin important dans le Saint-Laurent au cours des dernières années. Entre 1983 et 2000, dans la partie en amont du Saint-Laurent, le nombre d’anguilles juvéniles en montaison vers les Grands Lacs a chuté de 99,8 % à la passe migratoire du barrage de Moses-Saunders, à Cornwall. Depuis, l’abondance a augmenté à cet endroit et varie maintenant entre 40 000 et 50 000 juvéniles par année. La perte d’habitats de croissance attribuable à la construction de barrages, la mortalité par les turbines de centrales hydroélectriques et l’exploitation halieutique sont des exemples de facteurs qui auraient contribué au déclin de l’anguille.

Tableau 2. État des stocks de quelques espèces de poisson du fleuve Saint-Laurent et liste non exhaustive des pressions et perturbations qu’ils subissent.
| Espèces de poisson | Image | Tendance | Principales pressions | Mesures de gestion |
|---|---|---|---|---|
| Esturgeon jaune |
| À la hausse |
|
|
| Doré jaune | À la baisse* |
|
| |
Perchaude (Lac Saint-Pierre) | À la baisse |
|
| |
| Anguille d'Amérique |
| À la baisse |
|
|
| Bar rayé |
| À la hausse |
|
|
*Constat établi en 2010 avant l’entrée en vigueur du plan de gestion.
Une baisse de l’abondance de la perchaude et de plusieurs autres espèces de poissons associés à la plaine d’inondation et aux herbiers aquatiques a également été observée au lac Saint-Pierre. La perchaude du lac Saint-Pierre a connu un déclin important au cours des deux dernières décennies. Entre 2002 et 2013 seulement, l’abondance de la population a diminué de 68 %. Si la pêche a initialement contribué à cet effondrement, la perchaude a aussi souffert de la détérioration de ses habitats. La modification des communautés de plantes aquatiques et la prolifération de cyanobactéries benthiques ont engendré une cascade d’effets menant à une réduction de la croissance des jeunes perchaudes, de leur potentiel de survie et à l’échec du recrutement (figure 11) [voir la section « Enjeux et perspectives »].
Les abondances mesurées au filet maillant sont présentées pour différents groupes d’âge afin de mettre en lumière l’échec du recrutement de l’espèce. Il est à noter qu’un moratoire de cinq ans sur les pêches commerciale et sportive à la perchaude a été décrété au lac Saint-Pierre en 2012.
Description longue
La figure présente une série de cartes du lac Saint-Pierre, lesquelles correspondent à cinq différentes périodes d’échantillonnage des perchaudes de un et deux ans : 2002, 2007, 2009, 2011 et 2013. Les abondances mesurées au filet maillant sont présentées pour différents groupes d’âge afin de mettre en lumière l’échec du recrutement de l’espèce. Il est à noter qu’un moratoire de cinq ans sur les pêches commerciale et sportive à la perchaude a été décrété au lac Saint-Pierre en 2012. Sur les cartes, des cercles de différentes grosseurs présentent l’abondance, soit le nombre de captures par station (0, 1-5, 6-10, 11-25 et 26-65). De 2002 à 2013, on observe une diminution du nombre de perchaudes échantillonnées. Entre 2002 et 2007, cette diminution est très marquée pour les perchaudes de un an, et elle est très marquée pour les perchaudes de deux ans entre 2009 et 2011. En 2013, la majorité des stations présentent une abondance nulle ou très faible.
La situation de la perchaude est tout autre en amont, par exemple aux lacs Saint-François et Saint-Louis, près de Montréal, où la perchaude abonde et supporte une pêche sportive durable. Au lac Saint-Louis, la perchaude a connu un rétablissement notable au cours des vingt dernières années, particulièrement sur la rive sud où les efforts de réduction des rejets industriels semblent avoir porté leurs fruits. Les contrastes entre les différents secteurs du fleuve s’expliquent par le fait que des pressions supplémentaires s’exercent sur les populations de poissons du lac Saint-Pierre. L’effondrement de la population de perchaude, survenu malgré plusieurs mesures de gestion sévères visant à réduire, puis à éliminer la mortalité liée à la pêche, suggère maintenant d’examiner d’autres pistes de solution dans le but de retrouver la capacité de support du milieu qui prévalait dans le passé.
L’état des stocks de doré jaune évalué en 2010 indique une baisse des populations du fleuve Saint-Laurent. Dans le lac Saint-François et en aval du pont Laviolette, à Trois-Rivières, les populations sont en déclin en raison de la modification de l’habitat et de la pression de pêche. Cependant, la population de doré jaune du lac Saint-Louis est en bonne santé. Par ailleurs, l’espèce est considérée comme étant à risque dans le lac Saint-Pierre, où une augmentation du taux de mortalité et une baisse de l’abondance de femelles matures ont été observées. Un plan de gestion de l’espèce a été mis en place en 2011 pour l’ensemble du Québec afin d’améliorer l’état des stocks et la qualité de la pêche. Ce plan prévoit, pour le fleuve Saint-Laurent, la remise à l’eau des dorés jaunes de moins de 37 cm et de plus de 53 cm à la pêche sportive et commerciale afin de protéger les recrues et les géniteurs.
En somme, certaines espèces de poissons montrent des signes de rétablissement encourageants, suggérant que des pressions déterminantes se sont amoindries avec le temps. Les communautés de poissons du Saint-Laurent demeurent cependant très fragiles. Dans certains secteurs du Saint-Laurent, notamment au lac Saint-Pierre, les indices de détérioration de l’écosystème sont nombreux et la situation est devenue critique pour certaines espèces de poissons. Il reste donc de grands défis à relever pour assurer aux poissons du Saint-Laurent un milieu de vie sain, ce qui nécessitera la restauration d’habitats dans les plaines inondables et les grandes zones d’herbiers aquatiques, l’amélioration de la qualité de l’eau et l’amélioration de la connectivité entre les habitats.

Milieux humides
Description longue
Une carte des milieux humides des îles de Boucherville est présentée; le fond est une image satellitaire et les différents types de milieux humides y sont illustrés par différentes couleurs : le bleu pâle représente les eaux peu profondes, le mauve correspond aux bas marais, le jaune représente les hauts marais et le vert correspond aux marécages arborés. Les pointes de tarte sur la figure présentent les quatre éléments qui ont permis de caractériser l’état des milieux humides, à savoir la protection des fonctions des milieux humides, les pressions anthropiques qui les affectent, la dynamique interne et la diversité des habitats. Pour les îles de Boucherville, les constats relatifs à l’état de ces quatre éléments sont respectivement bon (vert), bon (vert), intermédiaire (jaune) et intermédiaire (jaune). Les tendances sont bon (vert), intermédiaire (jaune), mauvais (rouge) et intermédiaire (jaune). Le constat global associé à l’indicateur est intermédiaire-bon.
L’indicateur de la superficie des milieux humides en eau douce a été modifié pour incorporer quatre aspects : la pression anthropique directe sur la superficie, la dynamique interne des milieux humides, la diversité des habitats humides et la protection des milieux humides contre des agents stressants externes. Les secteurs des îles de Boucherville et du lac Saint-Pierre ont été examinés. L’état général des milieux humides de ces secteurs est qualifié d’intermédiaire-bon et la tendance générale est stable.

Description longue
Une carte des gains et des pertes de milieux humides au lac Saint-Pierre est présentée; le fond est une image satellitaire et les différents types de gains et de pertes y sont illustrés par différentes couleurs : le vert pâle représente les gains de milieux humides sur l’eau libre, le vert foncé correspond aux gains pérennes de milieux humides sur l’eau libre, le rose représente les pertes de milieux humides vers l’eau libre et le rouge correspond aux pertes anthropiques de milieux humides. Les pointes de tarte sur la figure présentent les quatre éléments qui ont permis de caractériser l’état des milieux humides, à savoir la protection des fonctions des milieux humides, les pressions anthropiques qui les affectent, la dynamique interne et la diversité des habitats. Pour le lac Saint-Pierre, les constats associés à l’état de ces quatre éléments sont respectivement mauvais (rouge), bon (vert), bon (vert) et bon (vert). Les tendances sont intermédiaire, stable, stable, stable (toutes caractérisées par la couleur jaune).
Les pressions anthropiques directes sur les milieux humides sont estimées par le bilan net des gains et pertes en superficie. Entre 2002 et 2010, aucune perte nette de superficie de milieux humides causée par des interventions humaines directes n'a été observée aux îles de Boucherville. Le bilan net des gains et pertes s’avère donc nul et est principalement dû au statut de parc conféré à ce secteur. Une différence de superficie est observée, mais résulte d’une baisse des niveaux d’eau entre les deux dates. En ce qui concerne le lac Saint-Pierre, le bilan net présente une augmentation de 64 ha de milieux humides entre 2002 et 2010. Il s’explique par une apparition de 101 ha de milieux humides, auxquels se soustraient 37 ha de milieux humides perdus au profit de l’agriculture. Par rapport à la période entre 1990 et 2002, la tendance est stable aux îles de Boucherville, car il n’y a pas eu de pertes additionnelles ni de gains observés. Toutefois, il reste que les 55 ha perdus pendant cette période n’ont pas été récupérés. Au lac Saint-Pierre, le gain net observé ne compense pas les pertes au profit de l’agriculture s’élevant à 789 ha observées entre 1990 et 2002. La tendance dans ce dernier secteur peut également être qualifiée de stable.
La dynamique interne des milieux humides est caractérisée par le rapport entre le total des superficies qui deviennent plus sèches et le total des superficies qui présentent des conditions plus humides (Jean et Létourneau, 2011). Dans le secteur des îles de Boucherville, les superficies des milieux humides s’étant asséchées s’élèvent à trois fois celles qui sont devenues plus humides entre 2002 et 2010. La transition de bas marais vers des hauts marais représente le plus important changement interne aux milieux humides. Pour le lac Saint-Pierre, toujours entre 2002 et 2010, les superficies des milieux humides s’étant asséchées s’élèvent à moins de deux fois celles qui sont devenues plus humides. Ici aussi la transition de bas marais vers des hauts marais représente le plus important changement observé. Depuis la fin des années 1970, trois périodes successives d’assèchement sont observées. À l’opposée, aucune période d’humidification n’a été détectée avec les données disponibles. La tendance est jugée mauvaise. Au lac Saint-Pierre, depuis la fin des années 1970, une période d’humidification moyenne des milieux humides est observée, suivie de deux périodes d’assèchement faibles. La tendance est dans ce cas intermédiaire.
La diversité des habitats humides est évaluée par le calcul de la proportion relative des cinq classes de milieux humides présents le long du Saint-Laurent (eau peu profonde ou herbier aquatique, bas marais, haut marais, marécage arbustif, marécage arboré). L’évaluation de la proportion relative des classes de milieux humides aux îles de Boucherville donne un constat intermédiaire. Les hauts marais représentent plus de la moitié de la superficie des milieux humides du secteur, alors que les marécages arbustifs sont absents. Par ailleurs, la proportion relative des classes de milieux humides au lac Saint-Pierre est jugée bonne. Les cinq classes de milieux humides sont bien représentées sur le territoire. Depuis 1990, la tendance est stable aux îles de Boucherville bien qu'on observe une inégalité accrue des classes de milieux humides. Pour ce qui est du lac Saint-Pierre, pour la même période, une légère augmentation dans la proportion relative des classes de milieux humides est observée. Cette tendance temporelle est toutefois jugée stable.
La protection des milieux humides contre les agents stressants externes est évaluée au moyen de la présence d’une zone de protection de 50 m de largeur constituée de milieux naturels terrestres en bordure des zones humides. Cette zone de protection est présente sur 76 % des limites des milieux humides du secteur des îles de Boucherville en 2010. Ce constat est bon. Les herbacées représentent la plus grande proportion de cette zone de protection. Au lac Saint-Pierre, cette zone de protection des milieux humides n’est présente que sur 26 % du périmètre des milieux humides et est constituée en quasi-totalité de forêts terrestres. Ce mauvais constat est attribuable à l’omniprésence de zones agricoles à proximité immédiate des milieux humides. Depuis 1990, on observe une amélioration de la zone de protection dans le secteur des îles de Boucherville, alors qu’au lac Saint-Pierre, la tendance temporelle de la zone de protection est stable.

Espèces enbahissantes
Description longue
La carte présente la situation géographique des sites d’échantillonnage des plantes envahissantes dans le tronçon fluvial s’étendant du lac Saint-François au lac Saint-Pierre et dans l’estuaire fluvial, de 2008 à 2010. La couleur vert correspond à un indice d’envahissement nul ou à une absence de plantes envahissantes, la couleur jaune représente un indice d’envahissement faible, la couleur orange correspond à un indice d’envahissement moyen et la couleur rouge représente un indice d’envahissement fort. Les sites sont ensuite regroupés en pointes de tarte par tronçon du fleuve. Lac Saint-François : jaune (67 %) et orange (33 %); lac Saint-Louis : vert (10 %), jaune (16 %), orange (53 %) et rouge (21 %); tronçon Montréal-Sorel : jaune (20 %), orange (40 %) et rouge (40 %); lac Saint-Pierre : jaune (11 %), orange (66 %) et rouge (23 %); estuaire fluvial : vert (8 %), jaune (33 %), orange (46 %) et rouge (13 %). Le constat global associé à l’indicateur est intermédiaire-mauvais.
Le suivi des plantes exotiques envahissantes des milieux humides du Saint-Laurent réalisé en collaboration avec les collectivités s’est poursuivi entre 2008 et 2010. Durant cette période, les ZIP du Haut-Saint-Laurent, Jacques-Cartier, du lac Saint-Pierre et des Deux-Rives ainsi que la Société d’aménagement de la baie Lavallière ont visité près de 300 sites répartis en eau peu profonde, dans les haut et bas marais ainsi que dans les marécages arbustifs et arborés. Les espèces suivies étaient l’alpiste roseau, le butome à ombelle, l’hydrocharide grenouillette, le myriophylle à épi, le roseau commun et la salicaire commune.
Les résultats obtenus entre 2008 et 2010 indiquent que sur l’ensemble des sites visités, 246 étaient touchés par les espèces ciblées. De ces sites, 22 % étaient fortement envahis, 56 % moyennement envahis et 19 % faiblement envahis. Les secteurs les plus fortement touchés par les plantes exotiques envahissantes sont les secteurs de Boucherville et du lac Saint-Pierre, alors que les secteurs les moins touchés sont le lac Saint-François et l’estuaire d’eau douce. Les espèces dominantes observées sont le roseau commun et l’alpiste roseau. La salicaire commune est l’espèce la plus fréquemment observée dans les milieux humides étudiés. Elle domine toutefois rarement les sites visités. Elle y est la plupart du temps faiblement ou moyennement représentée. L’ensemble des sites sera visité à nouveau entre 2012 et 2014. Il sera alors possible d’établir une tendance quant à l’évolution de l’envahissement des milieux humides du Saint-Laurent entre 2005 et 2014.

Contamination par les toxiques à travers les différentes composantes de l’écosystème.
Description longue
On peut observer une coupe transversale du fleuve présentant les différents indicateurs clés de l’écosystème aquatique d’eau douce qui concernent la contamination par les toxiques selon les catégories « eau », « sédiments » et « ressources biologiques », chaque indicateur étant représenté par un pictogramme. La composante « eau » est représentée par la contamination de l’eau par les toxiques; les sédiments sont représentés par l’indicateur « contamination des sédiments par les toxiques »; les ressources biologiques sont représentées par les communautés de macroinvertébrés benthiques, par la contamination des poissons par les toxiques et par la contamination du Grand Héron par les toxiques. Des flèches représentent la biomagnification des contaminants, qui partent de la rive (où une usine constitue une source potentielle de contaminants) pour aller vers l’eau, puis vers les sédiments, les macroinvertébrés benthiques et les poissons, pour ensuite être transférés au haut de la chaîne alimentaire, où l’on trouve le Grand Héron.
La présence de contaminants toxiques dans l’écosystème aquatique est un indicateur de sa perturbation et peut être suivie à travers les différentes composantes de ce dernier, soit l’eau, les sédiments et le vivant. En effet, certains contaminants, tels le mercure et les biphényles polychlorés (BPC), sont sujets à la bioaccumulation et à la biomagnification dans la chaîne alimentaire, ce qui peut entraîner des impacts négatifs importants sur les organismes vivants. Les sources de contaminants toxiques sont diverses : rejets industriels, effluents urbains ou ruissellement des terres agricoles (pesticides). Les contaminants peuvent être transportés dans l’eau sur de très longues distances en fonction de leur solubilité et des facteurs physiques, tel le débit. Ils sont parfois liés aux particules et se déposent dans les sédiments où ils peuvent être trappés, là où on observe une accumulation de sédiment, ou remobilisés où il y a érosion et transport de matériel sédimentaire. Les organismes benthiques vivant à l’interface des sédiments peuvent être affectés par la présence de contaminants en fonction de leur sensibilité relative et des concentrations de contaminants en présence. Les organismes benthiques servent de nourriture à de nombreuses autres espèces aquatiques, tels les jeunes poissons, qui peuvent être à leur tour mangées par des prédateurs plus grands (poissons, oiseaux ou mammifères) et les contaminants toxiques sont ainsi transférés et biomagnifiés dans la chaîne trophique.

Contamination par les toxiques dans l'eau
Description longue
La carte présente la situation géographique des sites d’échantillonnage de la contamination de l’eau par les toxiques. La première station est située à l’île Wolfe (à la sortie du lac Ontario), la deuxième se trouve à Carillon (le long de la rivière des Outaouais) et la troisième est située à Québec. La couleur vert correspond à des concentrations de contaminants sous les critères de protection de la vie aquatique et à un état non préoccupant, la couleur jaune correspond à des concentrations de contaminants près des critères et à un état à surveiller, la couleur rouge représente des dépassements de critères et un état préoccupant et la couleur blanche est utilisée pour les contaminants non mesurés à cette station et correspond donc à un état non déterminé. À chacune des stations, quatre groupes de substances sont présentés : les produits pharmaceutiques et de soins personnels (PPSP), les métaux, les pesticides et les PBDE. Station de l’île Wolfe : PPSP : blanc; métaux : vert; pesticides : vert (tendance à la hausse); PBDE : blanc. Station de Carillon : PPSP : jaune; métaux : vert; pesticides : vert; PBDE : jaune. Station de Québec : PPSP : jaune; métaux : vert; pesticides : vert (tendance à la baisse); PBDE : rouge (tendance à la hausse). Les sources des contaminants sont également notées sur la carte à l’aide de pictogrammes. Pour les pesticides : lac Ontario (jaune) et lac Saint-Pierre (rouge); pour les PPSP et les PBDE : région de Montréal (rouge); pour les métaux : tronçon Montréal-Sorel et estuaire fluvial (vert). Le constat global associé à l’indicateur est intermédiaire.
La quantité d’un contaminant rejeté dans un écosystème influe directement sur sa concentration dans le milieu aquatique. De même, l’origine d’un contaminant détermine en partie les variations de sa concentration dans le milieu aquatique. Les métaux sont présents naturellement dans les cours d’eau. Ce n’est que lorsque les concentrations dépassent un certain seuil que l’on peut conclure à une contribution importante des activités humaines. Les concentrations de métaux dans le Saint-Laurent ne dépassent pas les critères de qualité de l’eau pour la protection de la vie aquatique. En règle générale, les concentrations de pesticides mesurées dans le fleuve sont du même ordre de grandeur que celles mesurées à l’île Wolfe, à la sortie du lac Ontario. Cependant, à la station de Québec, des teneurs plus élevées sont observées en été à cause de l’épandage de pesticides sur les cultures situées dans les basses terres du Saint-Laurent, en particulier dans le bassin du lac Saint-Pierre. De 1995 à 2012, on note une nette diminution (de l’ordre de 50 %) des apports de pesticides vers l’estuaire. Cette diminution n’est pas observée dans les Grands Lacs, mais elle est substantielle dans les tributaires québécois, laissant supposer que la baisse observée dans le fleuve à Québec proviendrait de la baisse dans les tributaires. Notons cependant que cette baisse est sans doute attribuable à un changement de type de pesticide, puisque les pesticides modernes nécessitent de moins grandes quantités pour être efficaces. Les concentrations maximales de polybromodiphényléthers (PBDE) et de produits pharmaceutiques et de soins personnels (PPSP) se retrouvent en aval de la région de Montréal. Les concentrations de PBDE depuis 1995 ont augmenté considérablement à l’exutoire du fleuve, à Québec. Si nous ne pouvons évaluer de tendance pour les produits pharmaceutiques, le nombre et parfois les concentrations (par exemple pour les hormones) sont des sujets d’inquiétude.
Si l’eau du Saint-Laurent provient majoritairement du lac Ontario, il n’en va pas nécessairement de même pour les contaminants. Dans le Saint-Laurent, c’est l’affinité des contaminants avec les matières en suspension qui dictera, en grande partie, la source des contaminants. Ainsi, puisque le lac Ontario agit comme vaste bassin de décantation, les contaminants associés aux particules auront tendance à rester dans le lac sous forme de sédiments. Dans le Saint-Laurent, les particules en suspension et les contaminants qui y sont associés (métaux et PBDE) ne proviennent pas des Grands Lacs, mais plutôt de l’érosion, des effluents urbains ou industriels et des tributaires du fleuve. Par contre, les contaminants plus solubles, tels que les pesticides, proviennent dans une fraction non négligeable du lac Ontario, alors que les produits pharmaceutiques proviennent des effluents urbains.

Contamination par les toxiques dans les sédiments
Description longue
La carte présente les zones échantillonnées du fleuve où l’on trouve toujours de la contamination par les toxiques dans les sédiments. Le premier niveau d’information présente des zones du fleuve en vert (zones peu contaminées), jaune (zones contaminées) et rouge (zones très contaminées). L’information est ensuite regroupée par tronçons du fleuve pour illustrer, sous forme de pointes de tarte, la proportion des zones peu ou pas contaminées (vert, non préoccupant), contaminées (jaune, à surveiller) et très contaminées (rouge, préoccupant). Lac Saint-François : vert (58 %), jaune (25 %) et rouge (17 %). Les contaminants qui présentent des dépassements dans ce tronçon sont : BPC, dioxines, furanes et mercure. Lac Saint-Louis : vert (54 %), jaune (16 %), rouge (30 %). Les contaminants qui présentent des dépassements dans ce tronçon sont : BPC, dioxines, furanes, mercure, métaux et HAP. Tronçon Montréal-Sorel : vert (51 %), jaune (8 %) et rouge (41 %). Les contaminants qui présentent des dépassements dans ce tronçon sont : BPC, dioxines, furanes, mercure, métaux, HAP, PBDE, TBT et siloxanes. Lac Saint-Pierre : vert (91 %), jaune (4 %) et rouge (5 %). Les contaminants qui présentent des dépassements dans ce tronçon sont : mercure et PBDE. Québec : vert (55 %), jaune (20 %) et rouge (25 %). Les contaminants qui présentent des dépassements dans ce tronçon sont : métaux, HAP et BPC. Le constat global associé à l’indicateur est intermédiaire.
Les zones du fleuve en vert, jaune et rouge indiquent les zones où il y a présence de contamination à trois degrés de contamination (peu contaminé, contaminé et très contaminé). Les zones non contaminées ne sont pas illustrées mais sont comptabilisées dans le calcul des pointes de tarte. Les contaminants en encadré sont ceux qui dépassent les critères dans chaque tronçon du fleuve.
L’indicateur de surveillance de la qualité des sédiments vise à rendre compte, à intervalle régulier, de l’évolution de leur contamination dans le fleuve Saint-Laurent. Il permet de dresser un bilan de la présence de différentes substances toxiques et d’en dégager les tendances à long terme. Les données recueillies depuis les dernières années montrent une diminution substantielle de la concentration des contaminants légués par l’industrialisation du milieu du 20e siècle, aussi appelés contaminants historiques (voir la section « Enjeux et perspectives ») comme les BPC, les métaux, les hydrocarbures aromatiques polycycliques (HAP), le mercure et les dioxines et furanes. Les résultats récents permettent de cerner de nouvelles sources de contamination d’anciennes et de nouvelles substances organiques potentiellement néfastes pour l’écosystème aquatique comme les PBDE, les siloxanes et les tributhylétain (TBT).
La mise en place de programmes d’assainissement industriel et urbain ainsi que de nombreuses mesures d’atténuation des sources de contamination a eu des répercussions notables et rapides sur les concentrations des contaminants toxiques dans les sédiments. Il y a 30 ans, l’ensemble des sédiments des lacs fluviaux était contaminé par les métaux, le mercure, les BPC et les HAP. Aujourd’hui, ces contaminants ne représentent pas une menace réelle, sauf dans certains secteurs comme l’amont du lac Saint-François, le sud du lac Saint-Louis, le secteur en aval de Montréal, le delta de Sorel, au lac Saint-Pierre, et les ports de Montréal et de Québec. Enfin, les récents travaux montrent une augmentation des concentrations de nouvelles substances comme les substances retardatrices de flamme (PBDE) et la présence de substances émergentes provenant des émissaires urbains, comme les siloxanes.

Contamination des poissons
Description longue
La carte présente les constats relatifs à la contamination des poissons dans trois secteurs du fleuve : le lac Saint-François, le lac Saint-Louis et le lac Saint-Pierre. Les résultats sont présentés sous forme de pointes de tarte illustrant l’état de contamination de différentes espèces de poissons par différents contaminants. La couleur vert correspond à une contamination sous les critères de protection et à un état non préoccupant, la couleur jaune représente une contamination près des critères et un état à surveiller, et la couleur rouge correspond à un dépassement des critères et à un état préoccupant. Lac Saint-François : contamination par le mercure dans le grand brochet (vert), contamination par les PBDE dans le grand brochet (vert), contamination par les BPC dans le meunier noir (vert), contamination par les PBDE dans le meunier noir (vert), contamination par le mercure dans le doré jaune (vert) et contamination par les PBDE dans le doré jaune (vert). Lac Saint-Louis : contamination par le mercure dans le grand brochet (rouge), contamination par les PBDE dans le grand brochet (vert), contamination par les BPC dans le meunier noir (vert), contamination par les PBDE dans le meunier noir (vert), contamination par le mercure dans le doré jaune (jaune, tendance à la baisse) et contamination par les PBDE dans le doré jaune (vert). Lac Saint-Pierre : contamination par le mercure dans le grand brochet (vert, tendance à la baisse), contamination par les PBDE dans le grand brochet (vert), contamination par les BPC dans le meunier noir (jaune), contamination par les PBDE dans le meunier noir (jaune), contamination par le mercure dans le doré jaune (vert) et contamination par les PBDE dans le doré jaune (vert). Le constat global associé à l’indicateur est intermédiaire.
L’indicateur de la contamination des poissons examine plus particulièrement trois espèces : le doré jaune, le grand brochet et le meunier noir, et ce dans les trois lacs fluviaux du fleuve. Les teneurs moyennes en mercure (Hg) dans les dorés jaunes sont inférieures à la directive de Santé Canada de 0,5 mg/kg aux trois sites, mais au lac Saint-Louis les teneurs sont très près du critère, malgré une baisse depuis le dernier constat en 2008. Depuis, les teneurs moyennes en mercure dans les grands brochets sont inférieures à la directive de Santé Canada de 0,5 mg/kg au lac Saint-François et au lac Saint-Pierre, mais elles excèdent la directive au lac Saint-Louis. Les teneurs en mercure dans les grands brochets sont plus faibles en 2011 au lac Saint-Pierre. Les teneurs en BPC dans les meuniers noirs entiers mesurées en 2009 ou 2011 ne sont pas très différentes de celles mesurées antérieurement aux lacs Saint-François, Saint-Louis et Saint-Pierre. Les teneurs moyennes en BPC dans les meuniers noirs entiers sont plus élevées au lac Saint-Pierre qu’au lac Saint-François. Les teneurs moyennes en BPC dans les meuniers noirs sont inférieures au critère pour la protection de la faune piscivore dans les lacs Saint-François et Saint-Louis mais légèrement supérieures à celui-ci dans le lac Saint-Pierre. Les concentrations de PBDE dans la chair des dorés jaunes et des grands brochets dans les trois lacs sont inférieures aux critères pour la faune piscivore (44 ?g/kg et de 13 ?g/kg pour les tétra-BDE et les penta-BDE respectivement). Dans le meunier noir entier, les concentrations de PBDE sont inférieures aux critères pour la faune piscivore aux lacs Saint-François et Saint-Louis, mais très près du critère pour le lac Saint-Pierre.

Contamination du Grand Héron
Description longue
La carte présente les données touchant la contamination du Grand Héron à deux stations du tronçon fluvial : Île aux Hérons et Grande Île. Les contaminants examinés dans les œufs sont les suivants : BPC, PBDE, TCDD, DDE et Hg. La couleur vert représente une contamination sous les critères de protection, soit un état non préoccupant, la couleur jaune représente une contamination près des critères et un état à surveiller, et la couleur rouge correspond à des dépassements des critères et à un état préoccupant. Île aux Hérons : BPC (vert), PBDE (jaune), TCDD (vert), DDE (vert) et Hg (vert). Grande Île : BPC (vert), PBDE (jaune), TCDD (vert), DDE (vert) et Hg (vert). Deux graphiques présentent également la comparaison des concentrations des contaminants dans les œufs de Grand Héron entre les valeurs historiques et récentes. Île aux Hérons : mercure (1991-2011, baisse importante), BPC (1991-2011, faible baisse), DDE (1991-2011, baisse importante), ET-TCDD (2001-2006, faible baisse) et PBDE (2001-2011, baisse importante). Grande Île : mercure (1991-2011, faible baisse), BPC (1991-2011, baisse importante), DDE (1991-2011, baisse importante), ET-TCDD (1991-2006, faible baisse) et PBDE (2001-2011, baisse importante). Le constat global associé à l’indicateur est intermédiaire-bon.
Les concentrations les plus récentes de mercure, BPC, DDE, ET-TCDD et PBDE ont été comparées avec les données historiques (histogrammes) de même qu’avec des critères ou seuils de toxicité tirés de la littérature scientifique (pointes de tarte). Ces cinq contaminants ou groupes de contaminants sont les plus abondants et préoccupants retrouvés dans les oeufs de Grand Héron. Ces contaminants ont tous diminué depuis le début du suivi, tant à l’île aux Hérons qu’à la Grande Île. La diminution moyenne est de 62 % (36 à 94 %) à l’île aux Hérons et de 66 % (33 à 97 %) à Grande Île. Les pointes de tarte sur la carte indiquent que les concentrations de tous les contaminants sauf le penta-BDE sont inférieures aux critères aux deux colonies.
De manière générale, dans le corridor fluvial, les indicateurs de contamination indiquent tous une diminution des contaminants historiques (métaux, BPC, DDT). Pour ces substances, on n’observe plus de dépassement des critères de la protection de la vie aquatique dans l’eau et très peu dans les sédiments. La majorité des tendances sont à la baisse. Le constat est différent pour les contaminants émergents. Par exemple, la contamination par les PBDE présente quelques dépassements de critères et connaît une hausse des concentrations dans l'eau et les sédiments depuis la dernière décennie.

Estuaire et golfe
Description longue
On peut observer une coupe transversale du fleuve présentant les différents indicateurs clés de l’écosystème aquatique d’eau salée selon les catégories « eau » et « ressources biologiques », chaque indicateur étant représenté par un pictogramme. La composante « eau » est représentée par les processus océanographiques et par la salubrité des eaux coquillières; les ressources biologiques sont représentées par la contamination du Grand Héron, les oiseaux marins, le fou de Bassan, le béluga, le phytoplancton, le zooplancton, les algues toxiques et le bar rayé.

Paramètres physiques, chimiques et bactériologiques de l’eau et leurs effets sur l’écosystème
Processus océanographiques

Le Programme de monitorage de la zone atlantique (PMZA) permet de suivre l’évolution des variables océanographiques dans l’estuaire maritime et le golfe du Saint-Laurent grâce à la récolte d’un ensemble de données physiques (p. ex., température, salinité, couvert de glace, débit d’eau douce), chimiques (p. ex., oxygène dissous, éléments nutritifs, pH) et biologiques (p. ex., chlorophylle, zooplancton).
L’estuaire maritime et le golfe du Saint-Laurent présentent une stratification verticale importante selon la température et la salinité, suivant un cycle saisonnier. Le débit d’eau douce qui s’écoule dans l’estuaire a une grande influence sur la stratification et sur l’intensité de la circulation estuarienne. Depuis 1974, le débit d’eau douce moyen annuel est à la baisse de 10 %. Une crue printanière plus faible et plus tôt en saison a aussi été observée après les hivers doux de 2010 et de 2012.
Les eaux de surface estivales dans le golfe se réchauffent suivant l’augmentation de la température de l’air qui a progressé à un taux de 0,9 °C sur 100 ans depuis 1873, mais plus rapidement depuis les 20 dernières années. Les températures estivales ont battu des records de chaleur en 2006, suivi de près par 2012. De plus, l’étendue et le volume de glace de mer maximal atteint durant l’hiver ainsi que la durée de la saison de glace sont en décroissance dans le golfe depuis 1990. Les quasi-absences de glace survenues en 1969, 2010 et 2011 coïncident avec les trois seuls hivers qui ont connu des températures de l’air dépassant de 2 à 3 °C la normale saisonnière, nous donnant peut-être un avant-goût des conditions à venir d’ici une cinquantaine d’années selon les scénarios de changement climatique.
La couche intermédiaire froide (CIF) estivale est un vestige du refroidissement hivernal de la couche de surface qui est tranquillement érodée et réchauffée, mais néanmoins garde des températures par endroits sous 1 °C pour le reste de l’année. Sa température minimale moyenne a subi de grandes variations interannuelles, avec une longue période de froid intense entre 1986 et 1998. Depuis, il y a eu une élévation des températures, mais la moyenne en 2003 a été aussi basse que celles observées durant la période froide; 2003 a été également l’année avec le plus grand volume de glace observé dans le golfe (incluant l’exportation sur le Plateau néo-écossais) depuis 1969. À l’été 2012, la température minimale moyenne de la CIF a été la plus élevée depuis le record de 1980.
Les eaux de la couche d’eau profonde de l’estuaire maritime, située sous la CIF (> 150 m), proviennent du talus continental. Les eaux qui entrent par le détroit de Cabot circulent vers l’amont avec peu d’échange avec les eaux moins profondes, prenant de trois à quatre ans pour atteindre la tête de l’estuaire maritime. Ce faisant, leur concentration en oxygène dissous diminue en raison de la respiration des organismes pélagiques et benthiques. Les plus faibles concentrations d’oxygène dissous sont par conséquent observées dans les eaux profondes de l’estuaire maritime, lesquelles ont été brièvement hypoxiques au début des années 1960 et de façon persistante depuis 1984.
Parallèlement à la réduction de l’oxygène, le pH des eaux profondes (> 170 m) a diminué de 0,2 à 0,3 unité entre 1934 et 2010, soit une augmentation de l’acidité d’environ 100 %. Cette acidification entraîne une réduction du carbonate de calcium, lequel est nécessaire à la construction des coquilles et squelettes de plusieurs organismes, notamment les mollusques, les crustacés et les coraux. L’accumulation de dioxyde de carbone (CO2) anthropique provenant de l’atmosphère, l’origine des masses d’eaux et la décomposition de matière organique dans les eaux profondes seraient responsables de l’acidification du Saint-Laurent.
Phytoplancton, zooplancton et algues toxiques

Des changements sont observés dans les communautés de phytoplancton (p. ex., augmentation des flagellés et dinoflagellés) et de zooplancton (p. ex., augmentation en abondance des espèces de petits calanoïdes, modification de la phénologie), et le constat est que les conditions biologiques répondent aux variations environnementales de l’écosystème notées au cours des dernières années. Ainsi, on note des floraisons phytoplanctoniques anormalement plus hâtives dans le golfe du Saint-Laurent, et plus particulièrement en 2010 et 2012, deux années chaudes où la disparition de la glace est survenue tôt dans l’année. Ces changements dans l’environnement amènent également un risque accru de floraison d’algues toxiques. En ce qui concerne les espèces de copépodes indicatrices d’eau d’origine arctique, on note une diminution de leur abondance au cours de la période 2008-2012 relativement aux années 1990. Enfin, les changements notés dans la phénologie du cycle de production secondaire dans l’estuaire du Saint-Laurent au milieu des années 2000 semblent en réponse au réchauffement de l’écosystème et à la floraison phytoplanctonique plus hâtive. Ces modifications de la production planctonique peuvent avoir des conséquences sur les processus de recrutement et la productivité des niveaux trophiques supérieurs, incluant des espèces à valeurs commerciales. Ces variations de la dynamique de production s’ajoutent donc aux impacts directs sur les organismes de conditions telles que l’hypoxie et l’acidification.
Eaux coquillières
Description longue
La carte présente les différents secteurs de la zone marine où la salubrité des eaux coquillières est mesurée. Des pointes de tarte illustrent les proportions des différentes classes de recommandation de classification des secteurs en fonction du suivi de la qualité de l’eau. La couleur vert correspond à une recommandation pour un secteur agréé, la couleur jaune est associée à une recommandation pour un secteur agréé sous condition et la couleur rouge correspond à une recommandation pour un secteur restreint et interdit. Haute-Côte-Nord et Charlevoix : vert (38 %), jaune (14 %) et rouge (48 %). Moyenne-Côte-Nord : vert (50 %), jaune (2 %) et rouge (48 %). Basse-Côte-Nord : vert (65 %) et rouge (35 %). Bas-Saint-Laurent : vert (14 %), jaune (4 %) et rouge (82 %). Gaspésie : vert (18 %), jaune (13 %) et rouge (69 %). Îles-de-la-Madeleine : vert (77 %), jaune (5 %) et rouge (18 %). Le constat global associé à l’indicateur est intermédiaire-bon.
Globalement, pour l’ensemble des portions de rives évaluées, la qualité de l’eau est intermédiaire-bonne. Aux Îles-de-la-Madeleine, plus des trois quarts des secteurs évalués respectent les critères d’un secteur agréé ou agréé sous condition, et la majorité de ceux-ci respectent les critères d’un secteur agréé. La qualité de l’eau y est donc excellente. En Basse-Côte-Nord, près des deux tiers des secteurs évalués respectent les critères d’un secteur agréé. Cette région comporte une grande proportion de côte non définie en secteurs, mais dont la qualité de l’eau attendue serait excellente en raison de l’absence de sources de contamination à proximité. Globalement, la qualité de l’eau de cette région est excellente. Dans les régions de Haute-Côte-Nord/Charlevoix et de la Moyenne-Côte-Nord, environ la moitié des secteurs évalués respectent les critères d’un secteur agréé ou agréé sous condition, et l’autre moitié des secteurs ne respectent pas ces critères et sont interdits à la cueillette de mollusques. En Gaspésie, environ le tiers des secteurs évalués respectent les critères d’un secteur agréé ou agréé sous condition. Les deux tiers des secteurs évalués ne répondent pas à ces deux critères. Au Bas-St-Laurent, plus des trois quarts des secteurs évalués ne respectent pas les critères d’un secteur agréé ou agréé sous condition et sont interdits à la cueillette de mollusques.
Les eaux côtières sont très vulnérables aux impacts des activités humaines, et en 2013 la même tendance qu’en 2008 est constatée. La contamination bactérienne anthropique y cause toujours la perte d’usages comme la cueillette de myes et de moules. Cette problématique reste plus marquée en Gaspésie et au Bas-Saint-Laurent qu’aux Îles-de-la-Madeleine et le long de la Côte-Nord. Tout comme dans la partie fluviale, ce sont les eaux usées provenant des municipalités ou de résidences isolées ainsi que la présence d’activités agricoles qui sont les principales sources de contamination bactériologique. Peu de variation de la qualité de l’eau a été mesurée en ce qui concerne les secteurs coquilliers prioritaires entre 2008 et 2013, et aucun des 53 secteurs prioritaires n’a été rouvert durant cette période. Toutefois, des améliorations sur le plan des sources de contamination ont été réalisées dans certains secteurs en Gaspésie et en Haute-Côte-Nord. Il est probable que la qualité de l’eau se soit améliorée dans deux secteurs de la Côte-Nord à la suite de la construction et de la mise en service d’une usine de traitement des eaux usées (traitement secondaire) à Portneuf-sur-Mer, en 2011. Dans la baie de Gaspé, des efforts sont réalisés en continu afin d’améliorer l’usine de traitement des eaux usées en place. À long terme, une amélioration de la qualité de l’eau pourrait être observée avec la mise en œuvre du Règlement sur les effluents des systèmes d’assainissement des eaux usées de la Loi sur les pêches, qui favoriserait l’implantation et l’amélioration des usines de traitement des eaux usées.

Bars rayés
Description longue
La carte présente les constats relatifs à l’indicateur « bar rayé ». Les quatre éléments qui ont permis de caractériser l’état sont la répartition, l’abondance, la reproduction et la croissance. La couleur vert représente un indice de la santé de la population bon et non préoccupant, la couleur jaune correspond à un état intermédiaire et à surveiller, et la couleur rouge représente un état mauvais et préoccupant. Les résultats : répartition : vert; abondance : jaune; reproduction : jaune; croissance : vert. Des points sur la carte présentent les sites d’échantillonnage où la présence du bar rayé a été confirmée, et ce, selon trois catégories d’abondance : faible, moyenne et forte. Deux sites présentent une forte abondance : un premier site de reproduction a été localisé en 2011 à l’embouchure de la rivière du Sud, à Montmagny, et un autre site de reproduction a été localisé par la suite, en 2013, à l’embouchure de la rivière Ouelle, à Rivière-Ouelle. Le constat global associé à l’indicateur est intermédiaire-bon.
Historiquement, le bar rayé était principalement présent entre le lac Saint-Pierre et Kamouraska. Actuellement, à la suite des efforts de réintroduction de l’espèce, nous notons la présence de bars rayés dans l’ensemble du fleuve, entre Montréal et Rimouski (figure 22). Les bars rayés formant l’actuelle population du Saint-Laurent croissent plus rapidement que ceux de l’ancienne population. Il semble que la nourriture et les habitats de croissance dans le fleuve Saint-Laurent ne soient pas limitants pour le niveau d’abondance actuel de la nouvelle population de bars rayés. La capture en 2008 de jeunes de l’année, alors qu’aucun ensemencement de ce stade de développement n’avait été fait dans le fleuve, a confirmé la présence d’une reproduction naturelle. Cette observation a été suivie par la localisation en 2011 d’un premier site de reproduction dans l’embouchure de la rivière du Sud, à Montmagny, suivie en 2013 par la localisation d’un second site de reproduction dans l’embouchure de la rivière Ouelle, à Rivière-Ouelle (figure 23). Depuis 2010, il y a eu une augmentation exponentielle de l’abondance des juvéniles. Par contre, ceux-ci sont concentrés à quelques endroits et leur abondance demeure faible. L’aire de répartition est plus importante qu’auparavant et serait liée au comportement exploratoire d’une espèce en voie d’implantation dans un nouveau milieu. L’abondance du bar rayé dans le fleuve Saint-Laurent a considérablement augmenté depuis le dernier constat, bien qu’elle demeure faible. Le maintien de cette nouvelle population reste précaire. L’état des indicateurs utilisés ne permet pas encore un prélèvement et une exploitation durable de la ressource.

Description longue
La carte présente les endroits où la reproduction naturelle du bar rayé a été observée en eau salée. On y présente la localisation d’un premier site de reproduction, à l’embouchure de la rivière du Sud, à Montmagny, où la présence de bars rayés adultes et d’activité reproductrice a été observée, et celle d’un second site de reproduction à l’embouchure de la rivière Ouelle, à Rivière-Ouelle. La présence de jeunes de l’année a été observée à de nombreux sites. Un graphique montre le nombre de bars rayés juvéniles par mille mètres de tenture à anguille en fonction du temps (2004-2012). 2004 : 0; 2005 : 0,2; 2006 : 5; 2007 : 3,7; 2008 : 3,6; 2009 : 3,5; 2010 : 265,4; 2011 : 898,5; 2012 : 1176,3.

Population d'oiseaux marins et de fous de Bassan
Description longue
La carte présente les constats associés aux indicateurs « fou de Bassan » et « oiseaux marins ». Dans le cas du fou de Bassan, les éléments qui ont permis de caractériser l’état de la population sont l’abondance, le succès reproducteur et la contamination des œufs. En ce qui concerne les oiseaux marins, les populations évaluées sont le Goéland argenté, la Sterne caspienne, le Guillemot marmette, le Petit Pingouin et le Macareux moine. La couleur vert représente un indicateur de santé de la population bon et non préoccupant, la couleur jaune correspond à un état intermédiaire et à surveiller et la couleur rouge représente un état mauvais et préoccupant. Fou de Bassan : abondance : jaune (tendance à la baisse); succès reproducteur : rouge (tendance à la baisse); contamination : vert (tendance à la baisse). Oiseaux marins : Goéland argenté : vert (tendance stable); Sterne caspienne : rouge (tendance stable); Guillemot marmette : vert (tendance à la hausse); Petit Pingouin : vert (tendance à la hausse); Macareux moine : rouge (tendance à la baisse). Le constat global associé à l’indicateur « fou de Bassan » est intermédiaire-mauvais et le constat global associé à l’indicateur « oiseaux marins » est intermédiaire.
Oiseaux marins
La tendance récente de la population de chaque espèce dans les refuges est analysée selon les inventaires de 2005 et de 2010, mais aussi dans le contexte des données des inventaires quinquennaux depuis 1925. La population de Goéland argenté est demeurée stable; la Sterne caspienne est toujours présente, mais à nouveau avec trois individus seulement; le nombre de Guillemots marmettes a connu une forte hausse entre 2005 et 2010 (+77 %) et la population est actuellement à un niveau assez élevé; on observe une autre augmentation impressionnante de la population de Petit pingouin dans les refuges entre 2005 et 2010 (+61 %) et cette croissance est quasi constante depuis 1977; le Macareux moine a décliné modérément (-15 %) entre les deux derniers inventaires, mais il s’agissait de la troisième baisse consécutive de ses effectifs, soit un déclin de 54 % depuis 1993, si bien que l’estimation de la population en 2010 était la deuxième plus petite depuis 1925.
Lors du précédent portrait (à la suite de l’inventaire de 2005), on avait constaté que la population de Goéland argenté dans les refuges s’était stabilisée après 1993; ce constat n’a pas changé en 2010. Trois Sternes caspiennes avaient été trouvées en 2005, alors que l’espèce était absente lors des deux inventaires précédents. Cette réapparition était encourageante, mais le statut de l’espèce demeurait inquiétant. Sans croissance de population, le statut de l’espèce demeure excessivement précaire. Après un déclin préoccupant de 51 % entre 1998-1999 et 2005, les effectifs de Guillemots marmettes ont rebondi en 2010 pour retrouver un niveau élevé, près des maximums de 1993 et 1998-1999. Le constat pour cette espèce a donc changé de « à surveiller », en 2005, à « bon », en 2010. La croissance constante de la population de Petit pingouin depuis 1977 explique que le constat (bon) demeure le même en 2005 et 2010. Avec cette troisième baisse consécutive du nombre de Macareux moines dans les refuges, la tendance de la population apparaît résolument à la baisse et son niveau de plus en plus bas, ce qui explique pourquoi le constat est passé d’intermédiaire (en 2005) à mauvais (en 2010).
Fou de Bassan
La taille de la population est grande et est seulement 13 % inférieure au maximum enregistré en 2009, mais les signes de déclin après 2009 surviennent après une longue période (environ 30 ans) de croissance de la population. Le succès reproducteur est en baisse très inquiétante depuis 2009 et est actuellement trop faible pour maintenir la colonie. Des études complémentaires ont montré que les oiseaux semblent peiner à trouver leur nourriture et qu’ils doivent s’aventurer très loin de leur colonie pour se nourrir, ce qui affecterait leur succès reproducteur.
Lors du constat précédent, les trois indicateurs étaient à la hausse et la situation très positive. Mais depuis, même si les niveaux des contaminants ont continué à baisser en général, le succès reproducteur a diminué fortement pour atteindre les niveaux les plus bas jamais observés à l’île Bonaventure en 2011 et 2012. Un succès de reproduction aussi bas ne peut qu’entraîner un déclin de la population reproductrice à long terme (avec un délai de cinq à six ans, soit l’âge où les oiseaux commencent à se reproduire). Après 2009, la croissance de la population s’est arrêtée, la taille des deux principales colonies montrant des variations qui tendent plutôt vers une décroissance. Pour contrer cette tendance, il faudrait que le succès reproducteur remonte à 67 % (pourcentage des jeunes nés pendant l’année qui survivront jusqu’à l’envol).

Population de bélugas
Description longue
La carte présente les constats associés à l’indicateur « béluga » dans la zone d’étude qui se trouve dans le moyen estuaire et qui comprend le fjord du Saguenay. Les éléments qui ont permis de caractériser l’état de santé de la population sont l’abondance, la proportion de 0-1 an, le taux de mortalité et la contamination. La couleur vert représente un état bon et non préoccupant, la couleur jaune correspond à un état intermédiaire et à surveiller et la couleur rouge représente un état mauvais et préoccupant. État : abondance : rouge (tendance à la baisse); proportion de 0-1 an : rouge (tendance à la baisse); mortalité : jaune (tendance à la hausse); contamination : jaune (tendance à la baisse). Un graphique présente également l’estimation de la taille de la population des bélugas de l’estuaire du Saint-Laurent : l’abondance est passée de 8 000 individus en 1920 à 1 000 individus vers les années 1950. Une baisse récente est observée depuis 2002 et la population a atteint 889 individus en 2012. Le constat global associé à l’indicateur est mauvais.
Le modèle utilisé pour le suivi de la population de béluga du Saint-Laurent, intégrant les données jusqu’en 2012, estime que la population était stable ou légèrement croissante de la fin de la chasse dans les années 1960 jusqu’au début des années 2000, atteignant environ 1 000 individus en 2002, puis serait en déclin depuis pour atteindre 889 individus (IC 95 % : 672-1 167) en 2012. Toujours selon le modèle, des changements dans les paramètres vitaux et dans la structure d’âge seraient survenus dans la population de bélugas de l’estuaire du Saint-Laurent. On observe donc le passage d’une période de relative stabilité des paramètres vitaux avant 1998, caractérisée par des cycles de trois ans d’intervalle entre des maxima de mise bas, à une période d’instabilité caractérisée par un cycle de mise bas de deux ans, par une augmentation de la variabilité dans les taux de mortalité des nouveau-nés et des taux de gestation et par un déclin de la proportion de nouveau-nés et d’immatures dans la population. Les bélugas sont exposés au bruit et au dérangement par le trafic maritime, les activités de récréation et l’industrie d’observation. L’analyse de 28 indices décrivant l’écosystème a montré que les conditions ont changé dans le golfe du Saint-Laurent depuis la fin des années 1990. L’analyse de marqueurs chimiques dans les carcasses de bélugas de 1988 à 2012 indique un changement des sources de carbone (probablement liées à la diète) exploitées par les mâles et les femelles adultes depuis 2003. Un nombre inhabituellement élevé de carcasses de bélugas trouvées en 2008, incluant huit nouveau-nés et une gamme d’autres espèces, coïncidait avec une prolifération du dinoflagellé Alexandrium tamarense, qui produit des toxines paralysantes (saxitoxines) et il a été démontré que plusieurs animaux morts avaient été exposés aux saxitoxines. Le nombre de carcasses de nouveau-nés en 2010 et 2012 était huit et seize fois plus élevé que le nombre médian observé depuis 1983 et était vraisemblablement le résultat de la combinaison d’une augmentation de la production de jeunes et d’une diminution de la survie de ces jeunes. Ces mortalités sont survenues pendant une période de conditions de glace en dessous de la moyenne à long terme et de températures élevées de l’eau en 2012.

Contamination par les toxiques à travers les différentes composantes de l’écosystème en eau salée
Béluga
Le béluga du Saint-Laurent demeure un des mammifères marins les plus contaminés et si certains composés ont diminué au cours des dernières décennies, d’autres ont augmenté. Les concentrations de polluants organiques persistants historiques (ex. BPC, DDT) sont demeurées constantes ou ont légèrement diminué (Lebeuf et coll., 2014a). Les concentrations de PBDE, un polluant émergent, ont continué à augmenter chez les mâles adultes, mais le taux d’augmentation a diminué depuis le début des années 2000 (la série se termine en 2007). Chez les femelles adultes ainsi que chez les nouveau-nés, les concentrations de PBDE n’ont pas changé significativement depuis la fin des années 2000 (la série se termine en 2012 pour ces deux groupes)(Lebeuf et coll., 2014b).
Description longue
Un graphique présente la tendance temporelle de la contamination par les PBDE chez les bélugas mâles (bleu) et les bélugas femelles (rouge). Les barres verticales présentent l’écart-type et les tendances significatives sont identifiées par des segments de ligne. Entre 1990 et 2000, les concentrations de PBDE ont augmenté, tant chez les mâles que chez les femelles, passant de 3-4 ng/g de PBDE dans les lipides à environ 6 ng/g. Les concentrations de PBDE ont continué à augmenter chez les mâles adultes (6,5 ng/g en 2007), mais le taux d’augmentation a diminué depuis le début des années 2000 (la série se termine en 2008). Chez les femelles adultes et les nouveau-nés, les concentrations de PBDE n’augmentent plus depuis la fin des années 2000 (la série se termine en 2012 pour ces deux groupes).

Fou de Bassan
Les concentrations les plus récentes de mercure, BPC, DDE, ET-TCDD et PBDE ont été comparées avec les données historiques (histogrammes) de même qu’avec des critères ou seuils de toxicité tirés de la littérature scientifique. Ces contaminants ont tous diminué dans les oeufs de fou de Bassan de l’île Bonaventure depuis le début du suivi, sauf l’ET TCDD qui a augmenté entre 2004 et 2009. La diminution moyenne est de 52 % (13 à 99 %). Les concentrations de tous les contaminants sont inférieures aux critères.
Description longue
Un graphique présente la comparaison des concentrations de contaminants dans les œufs de fou de Bassan entre les valeurs historiques et récentes. Mercure (1969-2009) : baisse importante; BPC (1969-2009) : baisse importante; DDE (1969-2009) : baisse importante; ET-TCDD (2004-2009) : augmentation; PBDE (2004-2009) : baisse importante.

Description longue
La carte présente la contamination du Grand Héron aux deux stations situées en eau salée : île aux Basques et île Manowin. Les contaminants examinés dans les œufs sont les suivants : BPC, PBDE, TCDD, DDE et Hg. La couleur vert représente une contamination sous les critères de protection, soit un état non préoccupant, la couleur jaune représente une contamination près des critères et à surveiller, et la couleur rouge correspond à des dépassements des critères et à un état préoccupant. Île aux Basques : BPC : vert; PBDE : jaune; TCDD : vert; DDE : vert; Hg : vert. Île Manowin : BPC : vert; PBDE : vert; TCDD : vert; DDE : vert; Hg : vert. Deux graphiques présentent également la comparaison des concentrations de contaminants dans les œufs de Grand Héron entre les valeurs historiques et récentes. Île aux Basques : mercure (1992-2011) : baisse importante; BPC (1992-2011) : baisse importante; DDE (1992-2011) : baisse importante; ET-TCDD (2002-2007) : augmentation; et PBDE (2002-2011) : baisse importante. Île Manowin : mercure (1992-2011) : baisse importante; BPC (1992-2011) : baisse importante; DDE (1992-2011) : baisse importante; ET-TCDD (2007) : baisse importante; et PBDE (2007-2011) : baisse importante. Le constat global associé à l’indicateur est intermédiaire-bon.
Les concentrations les plus récentes de mercure, BPC, DDE, ET-TCDD et PBDE ont été comparées avec les données historiques (histogrammes) de même qu’avec des critères ou seuils de toxicité tirés de la littérature scientifique (pointes de tarte). Ces contaminants ont tous diminué aux deux colonies depuis le début du suivi, sauf l’ET-TCDD à l’île aux Basques. La diminution moyenne est de 32 % (-68 à 86 %) à l’île aux Basques et de 55 % (34 à 72 %) à l’île Manowin. Les concentrations de tous les contaminants sont inférieures aux critères aux deux colonies, sauf le penta-BDE à l’île aux Basques. Pour les dioxines, malgré une hausse par rapport à 2002 à l’île aux Basques, les concentrations restent inférieures à la valeur du critère.
Comme dans le corridor fluvial, les indicateurs de contamination dans l’estuaire et le golfe indiquent tous une diminution des contaminants historiques (mercure, BPC, DDT). L’ET-TCDD, bien qu’en concentration inférieure au critère, est plus élevé dans les oeufs de fous de Bassan que dans les oeufs de Grands hérons du corridor fluvial. En ce qui concerne les contaminants émergents, les PBDE augmentent chez le béluga et diminuent chez les oiseaux, bien que le penta-BDE dépasse le critère à l’île aux Basques.

Enjeux et perspectives
Problématique au lac Saint-Pierre : perte de capacité de support de l’habitat et perchaudes en déclin
Le lac Saint-Pierre constitue l’une des composantes majeures de l’écosystème du Saint-Laurent. Cette région a été désignée site Ramsar en 1998, selon la Convention sur les zones humides d’importance internationale, et Réserve mondiale de la biosphère en 2001 par l’UNESCO. Son archipel, dans la partie amont du lac, compte une centaine d’îles et chenaux et jusqu’à 40 % de tous les milieux humides du Saint-Laurent, lesquels abritent une richesse faunique et végétale exceptionnelle. Bien que son territoire demeure en majeure partie naturel, le lac Saint-Pierre a subi, depuis le 19e siècle, de nombreuses modifications causées par les activités humaines, notamment dans sa plaine d’inondation.
Description longue
La figure montre un gradient d’augmentation des apports en nutriments et ce qui en résulte dans l’écosystème aquatique. Lorsqu’il y a très peu de nutriments, le milieu est caractérisé d’oligotrophe, la disponibilité de lumière est très grande, et la biomasse est faible en ce qui concerne le plancton, le périphyton, les plantes aquatiques, les macroinvertébrés et les poissons. Le stade suivant, dit mésotrophe, est caractérisé par une eau claire et des plantes aquatiques nombreuses. Lorsque les apports en nutriments augmentent beaucoup, le milieu devient eutrophe, la biomasse augmente, tant en ce qui concerne les plantes que les macroinvertébrés et les poissons, mais on observe également l’apparition et l’augmentation d’algues filamenteuses, au départ fixées aux plantes, puis flottantes à la surface. Le dernier stade, dit hypereutrophe, est caractérisé par une eau turbide et une forte biomasse de phytoplancton, incluant des cyanobactéries, mais les plantes, macroinvertébrés et poissons y sont presque absents.
Les plantes aquatiques submergées constituent une composante majeure de l’habitat des poissons, leur fournissant un abri contre les prédateurs ainsi que le support physique pour les algues et les invertébrés dont ils s’alimentent. Dans leur état original, les milieux peu profonds supportent de faibles biomasses d’algues et de plantes submergées (figure 29). L’enrichissement par les éléments nutritifs favorise la croissance des herbiers aquatiques et accroît la productivité biologique, ce qui augmente la capacité de support des habitats pour les poissons. Cependant, au-delà d’un certain seuil critique, l’enrichissement excessif et la turbidité de l’eau défavorisent la croissance des herbiers submergés, engendrant ainsi la détérioration de l’habitat des poissons. Le passage des eaux enrichies des rivières Yamaska et Saint-François au travers d’un herbier dense situé à l’embouchure de ces rivières dans le lac Saint-Pierre illustre les liens entre les nutriments, les plantes aquatiques, les invertébrés et les poissons le long de la rive sud du lac Saint-Pierre (Hudon et coll., 2012). Après le passage de l’eau des tributaires dans l’herbier, plusieurs phénomènes se produisent :
- Le rapport Azote/Phosphore dissous est déséquilibré et l’azote inorganique disparaît;
- Ce changement induit la diminution et la disparition éventuelle des macrophytes, des algues filamenteuses et des épiphytes;
- Ces conditions d’éléments nutritifs et la disparition des compétiteurs favorisent le développement des cyanobactéries benthiques.
Les tapis de cyanobactéries représentent un habitat moins complexe et moins riche en proies pour les poissons, ce qui engendre une diminution de la croissance et de la survie des jeunes perchaudes et du nombre d’espèces de poissons adultes. La zone ainsi affectée représentait, avant ce changement, un vaste secteur de reproduction, d’alevinage, d’abri et de croissance pour une panoplie d’espèces de poissons. La présence de Lyngbia wollei et de Gleotrichia pisum (deux cyanobactéries) peut conséquemment servir d’indicateur de l’effet de l’eutrophisation sur l’écosystème aquatique du Saint-Laurent.
La perchaude (Perca flavescens) du lac Saint-Pierre a connu un déclin majeur à partir du milieu des années 1990. La situation est devenue si critique que le gouvernement du Québec a décrété, en 2012, un moratoire de cinq ans sur les pêches commerciale et sportive. Une étude récente de la situation (De la Chenelière et coll., 2014) a permis de constater que bien que la pêche ait contribué à l’effondrement, la perchaude a aussi souffert de la détérioration de ses habitats depuis les années 1950. L’analyse de l’utilisation du sol à partir de photographies aériennes, couplée à la modélisation des meilleurs habitats de reproduction dans la zone littorale, indique que 5 000 ha d’habitats printaniers ont été modifiés négativement par plusieurs activités anthropiques, principalement à vocation agricole. La disparition d’herbiers et la prolifération de cyanobactéries benthiques dans les zones de croissance des jeunes perchaudes, la diminution de la connectivité entre le lac et la zone littorale, le climat, l’implantation d’espèces exotiques compétitrices et l’introduction d’un nouveau prédateur aviaire (cormoran) ont contribué à l’échec du recrutement et au déclin de la perchaude. Les constats de détérioration du lac Saint-Pierre indiquent que la situation ne s’améliorera que lorsque les espèces pourront se reproduire et se développer dans un milieu sain, ce qui nécessitera la restauration d’habitats ainsi que l’amélioration de la qualité de l’eau et de la connectivité entre le lac et la zone littorale afin de permettre la récupération partielle ou totale de la capacité de support historique du milieu. L’état précaire de la perchaude, un maillon important des communautés aquatiques du lac Saint-Pierre, doit être interprété comme un indicateur parmi d’autres de la détérioration de cet écosystème exceptionnel.

Contamination historique et contamination émergente
Description longue
On peut observer une coupe transversale du fleuve présentant les différents indicateurs clés de l’écosystème aquatique d’eau douce qui concernent la contamination par les toxiques, chaque indicateur étant représenté par un pictogramme. Le schéma est séparé en deux parties : l’une représente la contamination historique, notamment la contamination par des métaux comme le mercure, et l’autre représente la contamination émergente, notamment la contamination par les PBDE. La contamination par les toxiques est observée dans l’eau, les sédiments, les poissons et le Grand Héron. Des flèches représentent la biomagnification des contaminants qui partent de la rive (où une usine constitue une source potentielle de contaminants) pour aller vers l’eau, puis vers les sédiments, les poissons, pour ensuite être transférés au haut de la chaîne alimentaire, où l’on trouve le Grand Héron. En ce qui concerne la contamination historique par le mercure, on n’observe plus de dépassement des critères de la protection de la vie aquatique dans l’eau, et on en observe très peu dans les sédiments et le vivant. La majorité des tendances sont à la baisse (eau : état bon, tendance stable; sédiments : état intermédiaire, tendance à la baisse; poissons : état intermédiaire, tendance à la baisse; Grand Héron : état bon, tendance à la baisse). À l’inverse, la contamination émergente, comme celle des PBDE, présente de nombreux dépassements de critères pour la vie aquatique et connaît une hausse des concentrations depuis la dernière décennie (eau : état mauvais, tendance à la hausse; sédiments : état mauvais, tendance à la hausse; poissons : état : intermédiaire, tendance stable; Grand Héron : état intermédiaire, tendance à la baisse).
En ce qui concerne la contamination par les toxiques dans le Saint-Laurent, on peut observer deux groupes de substances : la contamination historique, soit celle léguée par la révolution industrielle, et la contamination émergente, qui est en progression et correspond davantage à un signal provenant du développement urbain et industriel récent. La contamination historique correspond à celle des métaux, tel le mercure, et d’autres contaminants, tels les pesticides organochlorés et les BPC. La contamination émergente est constituée de nombreux groupes de substances, comme les PBDE et les PPSP. Les PBDE sont des produits ignifuges utilisés comme retardateurs de flamme dans les mousses de polyuréthane, les produits électroniques, les textiles et les plastiques depuis les années 1970. Les PPSP regroupent les médicaments (hormones, antidépresseurs, etc.) et les produits d’hygiène et de beauté. Bien que ces produits soient présents dans l’environnement depuis longtemps, le développement de méthodes d’analyse suffisamment sensibles pour les détecter est plus récent. Lorsqu’on observe séparément ces deux groupes de substances, on remarque des constats différents sur le plan de leur état et des tendances observées dans l’environnement. En ce qui concerne la contamination historique, on n’observe plus de dépassement des critères de la protection de la vie aquatique dans l’eau et très peu dans les sédiments et le vivant, et la majorité des tendances sont à la baisse. Par opposition, la contamination émergente, comme celle des PBDE, présente de nombreux dépassements de critères pour la vie aquatique et connaît une hausse des concentrations depuis la dernière décennie. Il pourrait être pertinent de considérer séparément ces groupes de substances dans les différents indicateurs sur la contamination afin de ne pas diluer les constats et d’obtenir une note moyenne ou intermédiaire sur le plan de leur constat global.
Certains PBDE ont un potentiel de bioaccumulation et peuvent provoquer des effets néfastes chez les animaux. Depuis la fin des années 1990, diverses mesures, comme le retrait volontaire de certains produits par les fabricants et des restrictions au Canada et d’autres pays, ont été mises en place et des diminutions des concentrations dans l’environnement sont déjà observées, notamment dans les oeufs de Grands hérons et de fous de Bassan du fleuve et du golfe Saint-Laurent. Ces restrictions ont cependant pour effet une augmentation de l’utilisation de produits ignifuges de remplacement, qui se retrouvent aussi dans les écosystèmes et dont les effets potentiels sont peu connus. Plusieurs de ces produits, comme l’hexabromocyclododécane (HBCDD), les polybromobiphényls (PBBS), l’hexabromobenzène (HBB) et le décabromodiphényl éthane (DBDPE) sont maintenant mesurés couramment dans les études scientifiques et certains programmes de suivi. Une fois dans l’environnement, plusieurs produits se dégradent sous l’effet de facteurs comme la lumière ou sont métabolisés par les organismes, formant ainsi de nouveaux produits qu’on peut également mesurer. On retrouve par exemple les BPC hydroxylés (OH-BPC) et les méthylsulfonyl-BPC (MeSO2-BPC), des produits de dégradation des BPC, dans les tissus d’oiseaux. Ces produits ne sont que quelques exemples de contaminants émergents qui pourraient être mesurés dans le cadre du programme de suivi au cours des prochaines années.
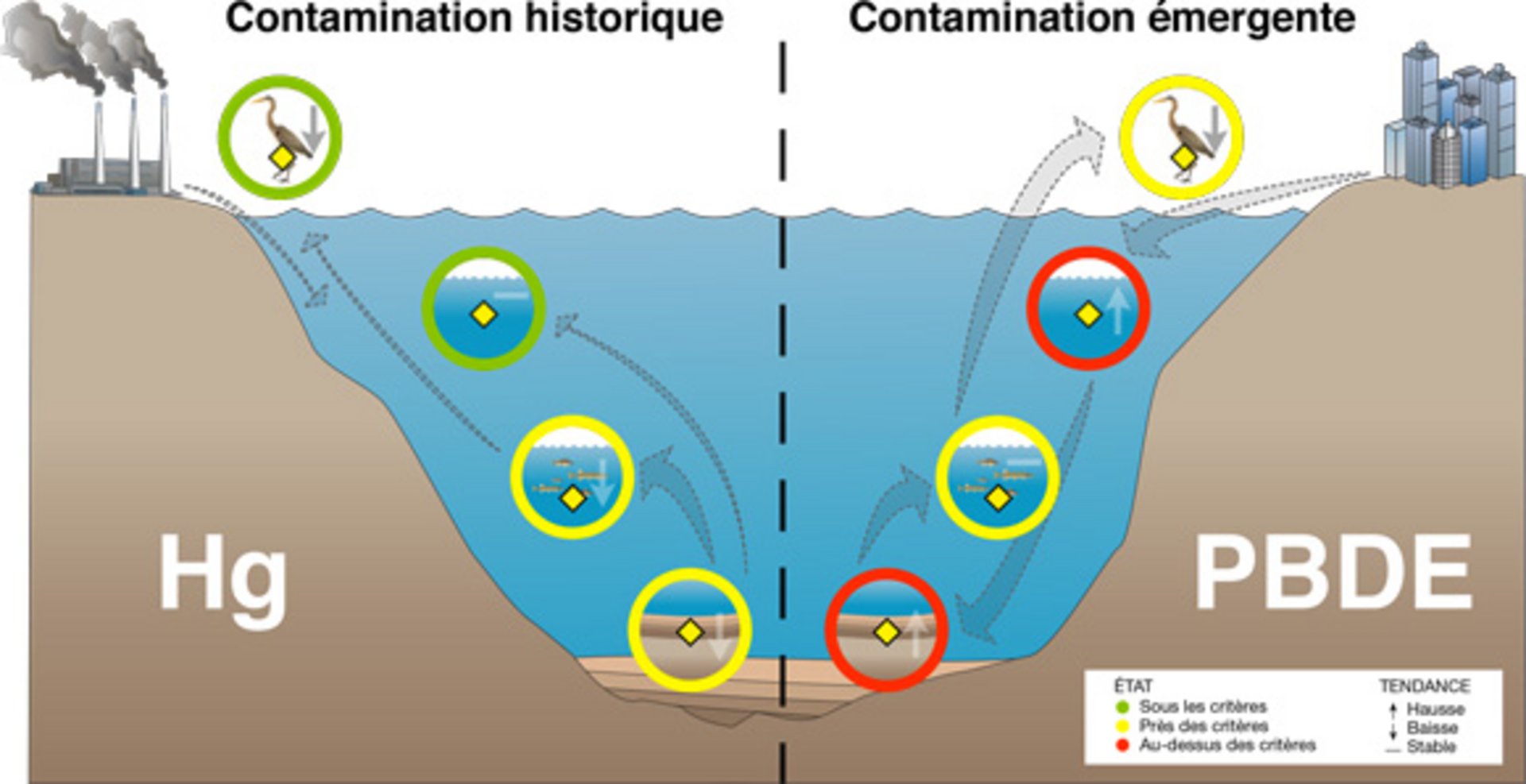
Production secondaire dans l’estuaire et le golfe

Le zooplancton constitue une composante majeure de l’écosystème de l’estuaire et du golfe du Saint-Laurent en agissant comme courroie de transmission entre la production primaire et les maillons supérieurs de la chaîne alimentaire. En effet, la survie des larves d’une grande variété d’espèces d’invertébrés et de poissons à valeur commerciale dépend de la disponibilité de proies zooplanctoniques adéquates et en quantité suffisante, ce qui pourrait contribuer au succès du recrutement et à la productivité de ces espèces dans le Saint-Laurent. De plus, les espèces de poissons pélagiques comme le capelan, le lançon, le hareng et le maquereau sont principalement planctivores et représentent donc un lien important entre le régime de production secondaire et les grands prédateurs piscivores.
Des changements d’abondance et de composition du zooplancton ainsi que de la saisonnalité de leur cycle de production ont été observés au cours des deux dernières décennies (Plourde et coll., 2013), résultant en différents régimes environnementaux caractérisés par des changements considérables de la dynamique de l’écosystème (Plourde et coll., 2013). Ces changements à la base de l’écosystème pourraient donc avoir un impact important sur la productivité d’espèces à grande valeur économique ainsi que sur la dynamique de grands prédateurs comme le béluga du Saint-Laurent et d’autres espèces de mammifères marins. Il est donc primordial de suivre l’évolution de ces changements à la base de l’écosystème dans le futur afin d’anticiper l’effet des changements climatiques sur l’écosystème du Saint-Laurent.
Référence :
PLOURDE, S., P. GALBRAITH, V. LESAGE, F. GRÉGOIRE, H. BOURDAGE, J. F. GOSSELIN, I. MCQUINN ET M. SCARRATT. 2013. « Ecosystem perspective on changes and anomalies in the Gulf of St. Lawrence: a context in support to the management of the St. Lawrence beluga whale population ». Pêches et Océans Canada, Secrétariat canadien de consultation scientifique, Document de recherche 2013/129, v + 30 p.
Un programme en constante évolution
Depuis son lancement en 2001, le programme Suivi de l’état du Saint-Laurent a été modifié de manière à prendre en compte les nouvelles connaissances scientifiques sur l’écosystème du Saint-Laurent. Ainsi, au fil du temps, des efforts particuliers ont été faits pour focaliser la collecte de données sur des secteurs écologiquement sensibles et soumis à de fortes pressions anthropiques selon les composantes de l’écosystème considérées. Une attention spéciale a également été portée aux substances d’intérêt et aux enjeux environnementaux émergents afin de prendre en compte les préoccupations soulevées et de mieux rendre compte de la situation. Les partenaires impliqués se sont également assurés que leurs activités de suivi respectives optimisaient les ressources disponibles pour la mise en œuvre du programme. Maintenir un ensemble comparable d’activités de suivi pertinentes à long terme n’en demeure pas moins un défi de tous les instants. L’engagement, la concertation et la complémentarité des activités prévues dans le cadre du programme, et réparties entre les partenaires, demeurent des facteurs clés favorisant le succès de cette démarche dans un esprit de continuité.
Pour maintenir un programme dynamique et utile à la prise de décisions relatives au Saint-Laurent, plusieurs défis pointent à l’horizon. Dans le futur, en plus d’intégrer les nouvelles connaissances permettant, notamment, le développement et l'amélioration des indicateurs environnementaux, les liens entre le suivi de l’état du Saint-Laurent et la prévision environnementale devront être explorés et renforcés au bénéfice des utilisateurs de l’information générée. Il en est de même de la complémentarité entre les résultats générés par ce programme, l’évaluation plus systématique de pressions exercées sur l’écosystème et de réponses mises de l’avant pour redresser l’état du Saint-Laurent, lesquelles expliquent en grande partie l’état du Saint-Laurent et les tendances observées.
Dans un contexte de gestion intégrée du Saint-Laurent, le programme Suivi de l’état du Saint-Laurent constitue un outil déterminant d’aide à la prise de décisions. Il requiert une vigilance constante de tous les acteurs impliqués afin que la mise en commun d’expertises scientifiques et de ressources réparties entre diverses organisations se poursuive dans le but ultime de diffuser de l’information sur l’état de santé de cet écosystème complexe. Les divers produits d’information qui en découlent continueront d’être disponibles sur une base régulière, de mettre l’accent sur l’intégration des résultats et d’alimenter l’élaboration de politiques environnementales visant la sauvegarde de ce grand fleuve qui constitue une richesse collective sans égale.
Glossaire
Bioaccumulation : Augmentation des concentrations de contaminants toxiques dans un organisme au fil du temps.
Biomagnification : Augmentation des concentrations de contaminants toxiques avec le niveau hiérarchique dans la chaîne alimentaire.
BPC (Biphényles polychlorés) : Groupe de 209 produits chimiques (variant de monoBPC à décachloroBPC en fonction de leur nombre d’atomes de chlore) utilisés en tant que diélectriques dans les transformateurs et les condensateurs électriques, dans les fluides caloporteurs, dans les additifs pour peinture ou dans les plastiques, l'huile de coupe et l'encre. En 1977, l'inquiétude entourant les effets des BPC sur l'environnement a mené à l'interdiction de leur fabrication et de leur importation en Amérique du Nord. Cette interdiction ne s'appliquait toutefois pas aux BPC déjà utilisés dans les applications électriques, qui sont en train d'être éliminés graduellement.
DDE (Ou p,p ‘-DDE) : Produit de dégradation du DDT le plus persistant et le plus toxique.
DDT (Dichlorodiphényltrichloroéthane) : Homologué pour la première fois comme pesticide en vertu de la Loi sur les produits antiparasitaires (LPA) dans les années 1940. Bien qu'il n'ait jamais été fabriqué au Canada, il a été largement utilisé dans les produits antiparasitaires dans les années 1960. Pour donner suite aux préoccupations croissantes exprimées au sujet de l'environnement et de la sécurité, la plupart des utilisations canadiennes du DDT ont été progressivement éliminées vers le milieu des années 1970. L'enregistrement de toutes les utilisations du DDT a été supprimé en 1985 à condition que les stocks existants soient vendus, utilisés ou éliminés au plus tard le 31 décembre 1990.
Dioxines et furanes : Les dibenzodioxines polychlorées et les dibenzofuranes polychlorés, couramment appelés « dioxines » et « furanes », sont des composés toxiques, persistants et bioaccumulables qui résultent principalement de l'activité humaine. On les trouve dans toutes les composantes des écosystèmes, y compris l’air, l’eau, le sol, les sédiments, les animaux et les aliments. Les dioxines et les furanes pénètrent dans l’environnement sous forme de mélanges complexes provenant de quatre sources principales : les produits chimiques commerciaux (p. ex., le pentachlorophénol); les incinérateurs; les usines de pâte où le chlore sert au blanchiment de la pâte; les incendies et les déversements accidentels qui laissent échapper des biphényles polychlorés (les BPC, qui contiennent des furanes comme principaux contaminants).
ET-TCDD : Équivalent toxique de 2,3,7,8-tétrachloro-dibenzo-dioxine. Le 2,3,7,8-tétrachloro-dibenzo-dioxine est le plus toxique des dioxines et furanes. L’équivalent toxique est une mesure calculée à partir de la toxicité relative d’un groupe de substances par rapport à celle du 2,3,7,8-TCDD. La 2,3,7,8-TCDD est reconnue comme étant le composé chimique le plus toxique connu présentement sur terre.
HAP (Hydrocarbures aromatiques polycycliques) : Les hydrocarbures aromatiques polycycliques (HAP) rejetés dans l'environnement canadien proviennent de sources naturelles et anthropiques. Les incendies de forêt constituent à eux seuls la plus importante source naturelle de HAP au Canada. Les sources anthropiques sont nombreuses et produisent des émissions de HAP dans tous les milieux. Les sources les plus importantes de rejets atmosphériques de HAP sont le chauffage au bois résidentiel et les alumineries. Les principales sources de rejets de HAP dans l'eau et le sol comprennent les produits traités à la créosote, les déversements de produits pétroliers, les usines métallurgiques et les cokeries, ainsi que les retombées de HAP présents dans l'atmosphère.
Mercure : Le mercure est un élément d'origine naturelle que l'on retrouve dans la croûte terrestre sous la forme de dépôts naturels prenant généralement l'apparence d'un minéral rouge vermillon appelé « cinabre ». Environ la moitié du mercure actuellement présent dans l'environnement provient d'activités humaines (comme la combustion du charbon et l'incinération des déchets), alors que l'autre moitié peut être attribuée à des sources ou à des processus naturels. Le mercure est persistant et s'accumule dans les organismes vivants (il est bioaccumulable). Le mercure figure actuellement sur la Liste des substances toxiques en vertu des dispositions de la Loi canadienne sur la protection de l'environnement (1999).
Métaux : Les métaux sont des éléments constitutifs de la croûte terrestre et sont, par conséquent, présents naturellement dans les cours d’eau. Ce n’est que lorsque leurs concentrations dépassent un certain seuil qu’on peut conclure à une contribution importante des activités humaines. Certains métaux comme le fer, le zinc ou le cuivre sont des oligoéléments indispensables à plusieurs organismes. Par contre, d'autres métaux ne font pas partie des éléments constitutifs de la matière vivante et, lorsqu’ils sont absorbés par l'organisme, ils peuvent se révéler toxiques. C’est le cas, par exemple, du plomb et du cadmium.
PBDE (Polybromodiphényléthers) : Groupe de 209 produits chimiques (variant de monoBDE à décaBDE en fonction de leur nombre d’atomes de brome) largement utilisés comme produits ignifuges (qui ralentissent l'inflammation et la propagation des flammes) dans les mousses de polyuréthane, les produits électroniques, les textiles, les plastiques et d’autres matériaux. Depuis 2006, l'utilisation de mélanges commerciaux pentaBDE et octaBDE a été éliminée progressivement à l'échelle internationale et au Canada.
PentaBDE : Voir PBDE.
Pesticides organochlorés : Les pesticides organochlorés sont les premiers pesticides de synthèse à apparaître sur le marché dans les années 1940. Ce sont généralement des insecticides qui, en raison de leur caractère persistant, bioaccumulable et toxique, sont actuellement interdits ou d’utilisation restreinte. Ils se divisent en cinq groupes selon leur structure chimique : le DDT et les composés associés, l’hexachlorocyclohexane (HCH), les cyclodiènes et les composés associés, le mirex et le toxaphène.
p,p’-DDE : Voir DDE.
POP (Polluants organiques persistants) : Terme général recouvrant les pesticides organochlorés, les produits chimiques industriels (les BPC et l'hexachlorobenzène) de même que les sous-produits et les contaminants (les dioxines et les furanes). Les polluants organiques persistants sont des substances toxiques rejetées dans l'environnement par diverses activités anthropiques. Ils ont des effets néfastes sur la santé des écosystèmes, des espèces sauvages et des gens.
PPSP (Produits pharmaceutiques et de soins personnels) : Ils regroupent les médicaments (hormones, antidépresseurs, etc.) et les produits d’hygiène et de beauté. Ils sont mesurés dans les eaux usées et de surface depuis une quinzaine d’années. On retrouve notamment l’ibuprofène et le triclosan.
Siloxanes (ou silicones) : Composés exclusivement anthropiques, ils sont produits industriellement à grande échelle. Ils sont composés d'une chaîne alcane et de groupements d’oxygène et de silice; leurs propriétés dépendent de la longueur de la chaîne Si-O. Ils peuvent être cycliques ou linéaires. Ils sont largement utilisés dans l'industrie des cosmétiques et de soins personnels (où ils sont appelés « methicones »). Ils sont aussi utilisés comme lubrifiants, comme nettoyants, dans les matériaux de construction, comme agents antimoussants, etc. Ils sont souvent très volatiles. En général, ce sont des composés très stables, ce qui les rend persistants dans l'environnement.
TBT (Tributhylétains) : Les tributylétains (TBT) font partie d'un groupe de substances appelées « organoétains », qui sont principalement utilisés dans la transformation de PVC (un type de plastique) et dans les pesticides. L’utilisation des TBT dans les peintures antisalissures (utilisées pour couvrir la coque des bateaux pour empêcher les organismes marins de s'y attacher) servant au revêtement de la coque des navires est maintenant interdite au Canada. Les TBT ont été ajoutés à la liste des substances toxiques (juin 2011) de l’annexe 1 de la LCPE (1999).
TétraBDE : Voir PBDE.
Participants et collaborateurs
Direction et orientation
- Hélène Bouchard, Environnement Canada
- Patricia Robitaille, ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques du Québec
Coordination scientifique, analyses et intégration
- Caroline Savage, Environnement Canada
Groupe de travail portrait global
- Louise Champoux, Environnement Canada
- Charley Cyr, Pêches et Océans Canada
- Serge Hébert, ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques du Québec
- Yves Paradis, ministère des Forêts, de la Faune et des Parcs du Québec
- Caroline Savage, Environnement Canada
Collaboration
Environnement Canada
- Alain Armellin
- André Bouchard
- Paul Boudreau
- Caroline Girard
- Christiane Hudon
- Martin Jean
- Guy Létourneau
- Magella Pelletier
- Lisa Pérusse
- Jean-François Rail
- Myriam Rondeau
- Julie Savaria
- Jacques Sénéchal
Ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques du Québec
- Zara Dionne
- Denis Laliberté
- Carl Martineau
Ministère des Forêts, de la Faune et des Parcs du Québec
- Michel Legault
- Anne-Marie Bouchard
- Guy Verreault
Parcs Canada
- Suzan Dionne
Pêches et Océans Canada
- Peter Galbraith
- Jean-François Gosselin
- Michel Lebeuf
- Lena Measures
- Stéphane Plourde
- Nathalie Simard
- Michel Starr
Stratégies Saint-Laurent
- Jean-Éric Turcotte
Coordination de production
- Geneviève Robert et Sophie-Anne Tremblay, ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques du Québec
- Julie Clavet-Drolet, Environnement Canada
Révision linguistique et traduction
- Sylvain Dumont, ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques du Québec
- Services intermédiaires de traduction et de révision, Environnement Canada
Conception graphique et infographie
- Schémas et pictogrammes : Martin Jean et Caroline Savage, Environnement Canada
- Plusieurs pictogrammes du document sont une gracieuseté du site Integration and Application Network, Université du Maryland Center for Environmental Science (ian.umces.edu/symbols/).
- Cartographie : Caroline Savage, Environnement Canada
- Source des fonds de carte de ArcGIS : Esri, DigitalGlobe, GeoEye, i-cubed, Earthstar Geographics, CNES/Airbus DS, USDA, USGS, AEX, Getmapping, Aerogrid, IGN, IGP, swisstopo, and the GIS User Community
- Montage graphique : Marie-Michèle Émond, ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques du Québec
Remerciements pour leur contribution
- L’ensemble des comités Zones d'intervention prioritaire (ZIP), et plus particulièrement le Comité ZIP Haut Saint-Laurent, le Comité ZIP Jacques-Cartier, le Comité ZIP Lac Saint-Pierre et le Comité ZIP Les Deux Rives, ainsi que la Société d’aménagement de la baie Lavallière pour la collecte de données.
- À citer : Groupe de travail Suivi de l’état du Saint-Laurent. 2014. Portrait global de l’état du Saint-Laurent 2014. Plan Saint-Laurent. Environnement Canada, ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques du Québec, ministère des Forêts, de la Faune et des Parcs du Québec, Parcs Canada, Pêches et Océans Canada et Stratégies Saint-Laurent, 53 p.
Références
LA VIOLETTE, N., D. FOURNIER, P. DUMONT ET Y. MAILHOT. 2003. Caractérisation des communautés de poissons et développement d’un indice d’intégrité biotique pour le fleuve Saint-Laurent, 1995-1997. Société de la faune et des parcs du Québec, Direction de la recherche sur la faune, 237 p.
JEAN, M., ET G. LÉTOURNEAU. 2011. Changements dans les milieux humides du fleuve Saint-Laurent de 1970 à 2002. Environnement Canada, Direction générale des sciences et de la technologie, Monitoring et surveillance de la qualité de l’eau au Québec, Rapport technique numéro 511, 302 p.
JEAN, M. ET G. LÉTOURNEAU. 2014. Les milieux humides en eau douce – 3e édition. Direction générale des sciences et de la technologie, Environnement Canada, Fiche d’information de la collection « Suivi de l’état du Saint-Laurent », Plan d’action Saint-Laurent. 9 p.
LEBEUF, M., MEASURES, L., NOËL, M., RAACH, M., TROTTIER, S. (2014a). A twenty-one year temporal trend of persistent organic pollutants in St. Lawrence Estuary beluga, Canada. Science of the Total Environment, 485-486, 377-386.
HUDON, C., A. CATTANEO, A. M. TOURVILLE POIRIER, P. BRODEUR, P. DUMONT, Y. MAILHOT, J. P. AMYOT, S. P. DESPATIE ET Y. DE LAFONTAINE. 2012. « Oligotrophication from wetland epuration alters the riverine trophic network and carrying capacity for fish ». Aquatic Sciences, vol. 74, no 3, p. 495-511.
DE LA CHENELIERE, V., P. BRODEUR ET M. MINGELBIER. 2014. « Restauration des habitats du lac Saint-Pierre : un prérequis au rétablissement de la perchaude ». Le Naturaliste canadien, vol. 138, no2, p. 50- 61.
LEBEUF, M., RAACH, M., MEASURES, L., MÉNARD, N., et HAMMILL, M. (2014b). Temporal trends of PBDEs in adult and newborn beluga (Delphinapterus leucas) from the St. Lawrence Estuary. DFO Can. Sci. Advis. Sec. Res. Doc. 2013/120. v + 11 p.
CHEN, D., R.J. LETCHER, N.M. BURGESS, L. CHAMPOUX, J.E. ELLIOTT, C.E. HEBERT, P. MARTIN, M. WAYLAND, D.V. CHIP WESELOH, L. WILSON 2012. « Flame Retardants in Eggs of Four Gull Species (Laridae) from Breeding Sites Spanning Atlantic to Pacific Canada. » Environmental Pollution 168: 1-9.



